
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
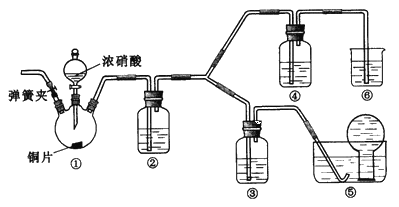
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H,2O
(1)装置①中发生反应的离子方程式是_______________________________________________________;
(2)装置②的目的是____________________,发生反应的化学方程式是____________________________________;
(3)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是____________;
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后____________________,__________________
(此操作的目的是_______________________________________________),最后滴加浓硝酸;
(5)该小组得出的结论所依据的实验现象是________________________________________________________。
【答案】 Cu + 4H+ + 2NO3-(浓) = Cu2++ 2NO2↑+ 2H2O 将NO2转化为NO(2分) 3NO2+ H2O = 2HNO3+ NO 3 mol/L稀硝酸 浓硝酸 氢氧化钠溶液 打开弹簧夹通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 赶走装置中空气(氧气) 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
【解析】验证浓硝酸的氧化性,应首先检查装置的气密性,硝酸与铜发生反应生成二氧化氮,通入水后生成一氧化氮,然后通过浓硝酸,如无色气体生成红棕色气体,可证明硝酸具有氧化性,可氧化一氧化氮,生成的气体不能直接排放到空气中,应有尾气处理装置,据此分析判断。
(1)装置①是铜和浓硝酸反应,其中发生反应的离子方程式为Cu + 4H+ + 2NO3-(浓) = Cu2++ 2NO2↑+ 2H2O;(2)装置①中反应生成了二氧化氮,在装置②中二氧化氮会与水反应,即3NO2+H2O=2HNO3+NO,所以装置②的作用是将NO2转化为NO;(3)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸,中盛放浓硝酸;(4)由于装置中残存的空气,能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,则实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内,最后滴加浓硝酸;(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明,装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯使溴水褪色与苯酚在空气中变粉红二者原理相同
B. 乙炔和聚氯乙烯都能发生加成反应
C. 只有有机物存在同分异构体,无机物没有同分异构体
D. 乙醛与氢气的加成反应也属于还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.1 g·mL-1,其中镁离子的质量分数为4.8%,100 mL该溶液中Cl-的物质的量约为( )
A. 0.37 mol B. 0.63 mol
C. 0.74 mol D. 0.44mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
①向溴乙烷中加入硝酸银溶液可检验溴元素;
②顺-2-丁烯和反-2-丁烯的加氢产物相同;
③苯和溴水混合可制溴苯;
④酸性高锰酸钾溶液可鉴别苯和甲苯
A. 只有①和④ B. 只有②和③ C. 只有①和③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠投入氯化亚铁溶液中:2Na+Fe2+===2Na++Fe
B. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
C. Fe3O4溶于稀硝酸中:Fe3O4+8H+===Fe2++2Fe3++4H2O ![]()
D. 澄清石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,所得溶液加入Ba(NO3)2有白色沉淀生成。写出辉铜矿与高锰酸钾反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)=2 mol/L,c(H2SO4)=4 mol/L的废酸混合液100 mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 。
(3)现有一块含有铜绿〔Cu2(OH)2CO3〕的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。

①固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。
②上述铜片中铜的生锈率为 (金属生锈率=![]() )。(结果保留到整数)
)。(结果保留到整数)
(4)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS)。
①硫化铜与氧气在淋滤作用下生成硫酸铜等,该过程的化学方程式为 。②写出渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式 ,请用简短的语言解释该反应发生的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.每摩尔物质约含有6.02×1023个粒子
B.摩尔是七个基本物理量之一
C.摩尔是物质的质量单位
D.摩尔是物质的数量单位
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com