
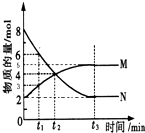
 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:分析 (1)根据图可知,在t2时刻气体N的物质的量在减小为反应物,M的物质的量在增加为生成物,反应的物质的量变化之比等于化学方程式计量数之比,据此书写化学方程式;
(2)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,据此答题;
(3)根据v=$\frac{△c}{△t}$计算反应速率;
(4)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=$\frac{消耗量}{起始量}$×100%计算;
(5)升高温度反应速率增大,据此答题.
解答 解:(1)根据图可知,在t2时刻气体N的物质的量在减小为反应物,M的物质的量在增加为生成物,反应的物质的量变化之比等于化学方程式计量数之比,n(N):n(M)=(8-2):(5-2)=2:1,则反应的化学方程式为:2N?M,故答案为:2N?M;
(2)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,故答案为:>;
(3)根据v=$\frac{△c}{△t}$计算得M的平均化学反应速率为$\frac{\frac{4mol-2mol}{4L}}{2min}$=0.25mol/(L•min),故答案为:0.25mol/(L•min);
(4)根据图可知,从反应开始N的物质的量在减小为反应物,M的物质的量在增加为生成物,根据转化率=$\frac{消耗量}{起始量}$×100%计算得N的转化率为$\frac{8mol-2mol}{8mol}$11111111×100%=75%,故答案为:75%;
(5)升高温度可逆反应中的正逆反应速率都增大,故答案为:增大.
点评 本题主要考查了化学反应速率的计算、转化率的计算、影响化学反应速率的因素等知识点,难度不大,解题时注意基础知识的灵活运用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1569.84kJ | B. | 78.584kJ | C. | 6548.6kJ | D. | 4978.88kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
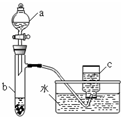 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用C表示的反应速率是0.2 mol/(L•s) | |
| C. | 2 min末的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 2 min内,用B和C表示的反应速率之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
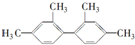 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 该烃苯环上的一氯取代物最多有4种 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com