
分析 由氧气体积可知氧气物质的量,根据2Na2O2+2H2O=4NaOH+O2↑计算过氧化钠的物质的量,进而计算Na2O的质量,再根据n=$\frac{m}{M}$计算氧化钠的物质的量;
根据钠离子守恒计算n(NaOH),根据m=nM计算NaOH的质量,溶液质量=固体质量+水的质量-生成氧气的质量,溶液质量分数=$\frac{NaOH质量}{溶液总质量}$×100%;
根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算NaOH的物质的量浓度.
解答 解:标况下,1.12L 氧气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,
2Na2O2+2H2O=4NaOH+O2↑
2 1
0.1mol 0.05mol
故混合物中Na2O的质量为14g-0.1mol×78g/mol=6.2g,则n(Na2O)=$\frac{6.2g}{62g/mol}$=0.1mol,
则原混合物中n(Na2O):n(Na2O2)=0.1mol:0.1mol=1:1;
根据钠离子守恒:n(NaOH)=2n(Na2O)+2n(Na2O2)=2(0.1mol+0.1mol)=0.4mol,
则m(NaOH)=0.4mol×40g/mol=15$\frac{0.4mol}{\frac{1}{1.18}L}$g,
溶液质量=14g+87.6g-0.05mol×32g/mol=100g
故所得溶液中NaOH的质量分数为$\frac{16g}{100g}$×100%=16%;
溶液体积为$\frac{100g}{1180g/L}$=$\frac{1}{1.18}$L,则c(NaOH)=$\frac{0.4mol}{\frac{1}{1.18}L}$=0.472mol/L,
答:原混合物中n(Na2O):n(Na2O2)=1:1;
所得溶液中NaOH的质量分数为16%;
溶液中NaOH的物质的量浓度为0.472mol/L.
点评 本题考查混合物有关计算,明确发生的反应即可解答,正确计算反应后溶液质量为解答关键,试题侧重考查学生分析计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 都具有脱水性 | |
| B. | 在加热条件下都能与碳反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀中一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 | |
| D. | 原溶液中一定有K+,且c(K+)≥0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g金属钠 | B. | 1mol/L BaCl2溶液100mL | ||
| C. | 56g金属铁 | D. | 20% NaOH溶液50g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
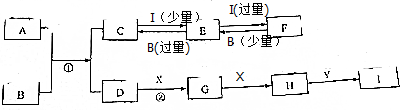
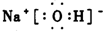 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-甲基-3-乙基丁烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,4-3甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于浓盐酸中,然后稀释至所需浓度 | |
| C. | pH=9的CH3COONa溶液和PH=9的NaOH溶液中,水的电离程度相当 | |
| D. | 以金属铝为阳极电解足量的NaOH溶液,阳极区域没有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 铁和稀硝酸反应后,溶液pH=2 Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| D. | 向银氨溶液中加入盐酸[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com