
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 | |
| C. | 正极为Fe,负极为Cu,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Zn,电解质溶液为CuSO4溶液 |
分析 根据反应“2Fe3++Fe=3Fe2+”可知,反应中铁被氧化,应为原电池负极,因失电子而被氧化;正极应为活泼性比铁弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为含Fe3+的盐.
解答 解:A.铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为FeCl3溶液,所以是能实现该反应的原电池,故A正确;
B.铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为Fe(NO3)2,由于Fe与亚铁离子不反应,所以不能实现该反应的原电池,故B错误;
C.Fe的活泼性大于Cu,Fe作负极,Cu作正极,电解质溶液为硫酸铁,Cu不能作负极,故C错误;
D.铁的活泼性大于银,铁作负极,银作正极,电解质溶液为硫酸铜,所以是不能实现该反应的原电池,故D错误;
故选A.
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度确定原电池的电极材料及电解质溶液.


科目:高中化学 来源: 题型:解答题
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能存在NaCl | B. | 可能存在Na2SO4 | C. | 一定存在FeCl3 | D. | 一定存在Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
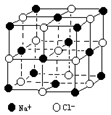 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓氢氧化钠溶液中通入少量的CO2气体:CO2+OH-═HCO3- | |
| B. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 向Na2S2O3溶液中通入过量的氯气:S2O32-+2Cl-+3H2O═2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O=4NaOH+O2↑ | B. | 2F2+2H2O=4HF+O2 | ||
| C. | 3NO2+H2O=NO+2HNO3 | D. | 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
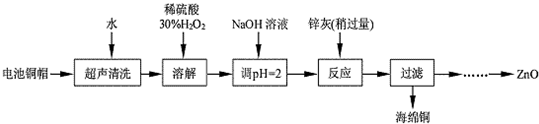
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 1.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com