
| A. | 在①中金属片Y发生还原反应 | |
| B. | 在②中金属片W作负极 | |
| C. | 上述四种金属的活动性顺序为W<X<Z<Y | |
| D. | 如果把Y、W用导线相连后同时浸入稀硫酸溶液,则电子流动方向为Y→导线→W |
分析 在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上发生氧化反应、正极上发生还原反应;电子从负极沿导线流向正极.
①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,Y溶解,说明X是正极、Y是负极,则金属活动性Y>X;
②把Z、W用导线连接后同时浸入稀硫酸溶液中,W发生还原反应,则W是正极、Z是负极,金属活动性Z>W;
③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z,则X是负极、Z是正极,金属活动性X>Z,
通过以上分析知,金属活动性顺序是Y>X>Z>W,据此解答.
解答 解:A.在①中,Y是负极、X是正极,负极上X得电子发生还原反应,故A错误;
B.在②中,金属片Z作负极、W作正极,故B错误;
C.通过以上分析知,上述四种金属的活动顺序是Y>X>Z>W,故C错误;
D.金属性Y>W,如果把Y、W用导线连接后同时浸入稀硫酸溶液,构成原电池,Y是负极、W是正极,则电子流动方向为Y→导线→W,故D正确;
故选D.
点评 本题考查原电池的工作原理,为高频考点,把握原电池的正负极反应、电子的移动方向为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
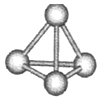 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于由非极性键构成的极性分子 | |
| B. | 氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | |
| C. | lmol N4气体转变为N2气体放出888kJ热量 | |
| D. | N4与N2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.
A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
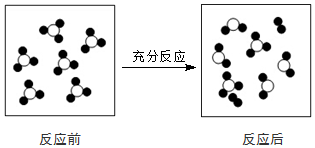
| A. | 一定属于分解反应 | B. | 一定属于氧化还原反应 | ||
| C. | 一定属于放热反应 | D. | 一定属于可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
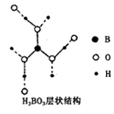 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第3周期元素氢化物的稳定性顺 序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | NCl3中N原子是sp3杂化,则BCl3中B原子也是sp3杂化 | |
| D. | 干冰CO2是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | 溶液pH值增大 | ||
| C. | 溶液中c(Ca2+)增大 | D. | 溶液pH值不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com