
将2 mol I2(g)和1 mol H2置于某2 L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)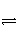
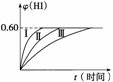
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为__________。
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________(填入下列条件的序号,下同),乙条件可能是__________。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________。
答案 (1)0.55 mol·L-1 (2)③⑤ ① (3)4b+c=2a
解析 (1)设I2的变化浓度为x mol·L-1,则:
I2(g)+H2(g)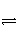
 2HI(g)
2HI(g)
起始量(mol·L-1) 1 0.5 0
变化量(mol·L-1) x x 2x
平衡量(mol·L-1) 1-x 0.5-x 2x
φ(HI)=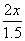 ×100%=60%
×100%=60%
解得x=0.45 则1-x=0.55
(2)解本小题的关键点是平衡没有移动。
(3) I2(g)+H2(g)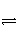
 2HI(g)
2HI(g)
起始量/mol a b c
极限转化量/mol a+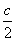 b+
b+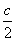 0
0
因为(3)中达到的平衡状态与(1)中达到的平衡状态等效,
故(a+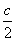 )∶(b+
)∶(b+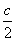 )=2∶1
)=2∶1
即4b+c=2a


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
配制100mL 1 mol·L-1的NaOH溶液,下列操作中错误的是
A.在托盘天平上放两张大小相等的纸片,然后将NaOH固体放在纸片上进行称量
B.把称得的NaOH放入适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也移入容量瓶中
D.距刻度1—2cm时,用胶头滴管加入蒸馏水,直到液体凹面最低点恰好与刻度相切
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是( )
A.等物质的量的CH4在反应①、②中转移电子数相同
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol
C.4NO2(g)+2N2(g)=8NO(g);△H=+586kJ/mol
D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)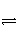
 qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应CO2(g)+H2(g)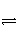
 CO(g)+H2O(g),其
CO(g)+H2O(g),其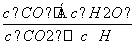 =K,K被称为化学平衡常数,其中K和温度的关系如下表:
=K,K被称为化学平衡常数,其中K和温度的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是( )
A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.此反应达到1 000 ℃时的反应速率比700 ℃时大
D.该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物的命名正确的是( )
A.2,2二甲基3丁烯
B.2,3二甲基3乙基丁烷
C.3,3,5,5四甲基己烷
D.2甲基1,3丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
( )。
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮酸钠(NaN3)是抗甲型H1N1流行感冒药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有________。(答案可能不止一个)
a.离子键
b.极性共价键
c.非极性共价键
(2)3 mol NaN3受撞击会生成4 mol氮气和1 mol离子化合物A,可用于汽车保护气囊。请写出:
①有关反应的化学方程式:___________________________________。
②A的电子式___________________________________________________。
(3)写出与N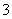 是等电子体的物质的化学式________(两种),等电子体的微粒往往具有相似的结构,试预测N
是等电子体的物质的化学式________(两种),等电子体的微粒往往具有相似的结构,试预测N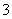 的构型________。
的构型________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com