
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+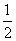 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+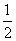 O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH2)(s) ΔH8
A.① B.④
C.②③④ D.①②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
X为短周期元素组成的单质,有下列转化关系:X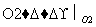 XnOm
XnOm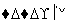 盐,下列相关叙述正确的是( )
盐,下列相关叙述正确的是( )
A.①②一定都是氧化还原反应
B.①②都不是氧化还原反应
C.XnOm一定是酸性氧化物
D.XnOm是金属氧化物或非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方 程式_______________________________________________。
程式_______________________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是________g,溶液中的c(SO42-)=________mol·L-1。
(3)若欲在如图所示的装置中发生反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中。
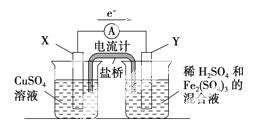
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | |||
| Y极 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、H Br、HI的酸性
Br、HI的酸性
(3)工业上, 通过如下转化可制得KClO3晶体:
通过如下转化可制得KClO3晶体:
NaCl溶液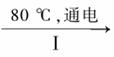 NaClO3溶液
NaClO3溶液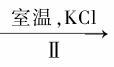 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因 是 。
是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了合理 利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量 。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形 成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2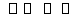 2NH3 ΔH=a kJ·mol-1。
2NH3 ΔH=a kJ·mol-1。
试根据表中所列键能数据计算a的数值(列出简单的计算式):________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g)
ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是( )
| X | Y | |
| Z | W |
A.元素X和元素W最高正价代数和一定为8
B.若元素X的原子序数为a,则Z的原子序数一定为a+9
C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物
D.原子半径的大小顺序为rW>rZ>rX>rY
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol/LNH4Cl 溶液与2 L 0.25 mol/LNH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) >c(HCO3-) >c(CO32-)>c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A.①②④ B.①③⑤ C.③⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com