
【题目】某同学设计了如下实验测量mg铜银合金样品中铜的质量分数: 
下列说法中不正确的是( )
A.铜、银都能与硝酸反应,收集到的VL气体全为NO
B.操作I、II、III分别为过滤、洗涤、干燥
C.利用气体体积VL及样品质量mg可计算铜的质量分数
D.久置的银器变黑、铜绿的形成都发生了氧化还原反应
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.碳酸钠可用于制玻璃、造纸等B.电解饱和食盐水可制取金属钠
C.碳酸钡在医疗上用做“钡餐”D.氢氧化铁胶体可用于饮用水的消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应同时又是放热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 铝与稀盐酸
C. 灼热的炭与水蒸气生成一氧化碳和氢气的反应 D. 氧化铁和稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2 (g)+1/2O2(g) ![]() SO3(g) △H=-98 kJ/mol。
SO3(g) △H=-98 kJ/mol。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入4.0mol SO2 (g)、9.0 mol O2(g)和4.0 mol SO3(g),则反应开始时v(正)_____ v(逆)(填“<”、 “>”或“=”)。
(2)一定温度下,向一带活塞的体积为2L的密闭容器中充入2.0 mol SO2和1.0molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为___________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2 (g)平衡浓度比原平减小的是____(填字母)。
A.保持温度和容器体积不变,充入1.0mol O2 B.降低温度
C.保持温度和容器内压强不变,充入1.0 molSO3 D.移动活塞压缩气体
(4)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为Na2SO3(s)+H2SO4(98%)![]() Na2SO4+H2O+SO2↑。
Na2SO4+H2O+SO2↑。

①根据实验需要,应该在I、II、Ⅲ处连接合适的装置。请从下图A--E装置中选择最适合装置并将其序号填入下面的空格中。I、II、Ⅲ处连接的装置分别是______________________。

②从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________。
③通过测量装置________的增重来计算SO2的转化率。
④将SO2通入含1.5 mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×l023个电子转移时,该反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列与化学有关的叙述正确的是( )
A.酸性KMnO4溶液浸泡过的硅藻土可用于水果保鲜
B.对“地沟油”进行分馏可制得汽油、煤油,达到变废为宝的目的
C.煤的干馏可以得到苯、甲苯等烃,不能得到无机物
D.只用淀粉溶液即可检验食盐是否为加碘盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有八种物质:①甲烷、②苯、③聚乙烯、④氯乙烯、⑤2—丁炔、⑥环己烷、⑦邻二甲苯、⑧乙醛,既能使酸性高锰酸钾溶液褪色,又能与溴水反应使之褪色的是( )
A.③④⑤⑧B.④⑤⑦⑧C.④⑤⑧D.②③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图: 
(1)连接好装置后,实验前必须进行的一步操作是 . 仪器a的名称为 .
(2)B装置中盛放的试剂是 , C中发生反应的化学方程式为 .
(3)该兴趣小组设计此实验依据的原理是 , 通过(填实验现象),可判断碳的非金属性强于硅的非金属性.请你再列举出一条事实,说明碳的非金属性强于硅的非金属性: .
(4)该小组的一位同学认为,利用此实验装置及药品,也可以证明非金属性Cl>C>Si,你是否同意该同学的观点?(填“同意”或“不同意”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图,不能得出的结论是( ) 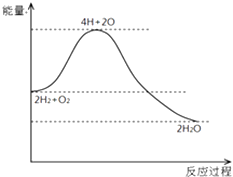
A.H2与O2反应是放热反应
B.断开化学键要放出能量
C.化学反应伴随着物质变化和能量变化
D.2mol H2和1mol O2具有的总能量高于2mol H2O 的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com