
(12分)在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡时N2的转化率为40%,求:
(1)平衡时v (NH3)的速率
(2)求该温度下的平衡常数K(列出算式,不用计算出结果)
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强与起始时压强之比
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届四川省高三秋季零诊考试化学试卷(解析版) 题型:选择题
利用下图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶 液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知X.Y.Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
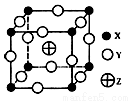
A.ZX4Y8 B.ZX2Y6 C.ZXY3 D.ZX8Y12
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列有关实验的做法不正确的是
A.分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.容量瓶使用前需要检查是否漏水
C.配置0.1000 mol·L—1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月月考化学试卷(解析版) 题型:实验题
(18分)氮化铝(AlN0是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品,接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
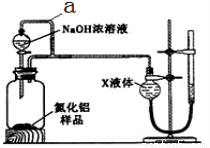
(4)为测定生成气体的体积,量气装置中的X液体可以是 (填选项序号)。
a.CCl4 b.C6H6 c.NH4Cl溶液 d.H2O
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数是 (用含m、V的数学表达式表示)。
【方案3】按以下步骤测定样品中A1N的纯度:
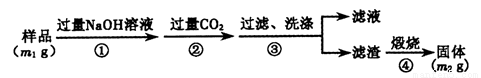
(6)步骤②生成沉淀的离子方程式为 。
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如图所示:
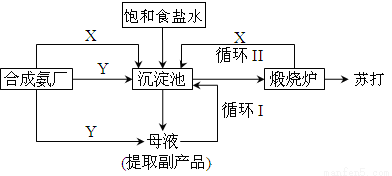
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)_____________、______________。
(2)侯氏制碱法的最终产物是(化学式)_______________;其在水溶液中显著的实质是(离子方程式):__________________。
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:______________、_____________。这两种气体在使用过程中是否需要考虑添加的顺序?____________(填“是”或“否”),原因是_______________。
(4)在沉淀池中发生的反应的化学方程式是_________________。
(5)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了_____________(填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是______________(举一例)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:填空题
(16分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+CO2(g)+ 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g)+ 4NO(g)= 2N2(g)+CO2(g)+ 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+ 3CH4(g) 2Fe(s)+ 3CO(g)+6H2(g) ΔH>0
2Fe(s)+ 3CO(g)+6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:
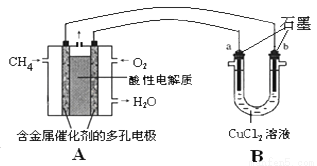
请回答:
①甲烷燃料电池的负极反应式是:__________________________。
②当A中消耗0.05mol氧气时,B中________________极(填“a”或“b”)增重________________g。
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:选择题
实验中的下列操作正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com