
煤炭、一氧化碳、氢气都是重要能源,已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+ 1/2O2(g) =H2O(g) ΔH2=-241.6 kJ·mol-1
③CO(g)+1/2O2(g) =CO2(g) ΔH3=-283.0 kJ·mol-1
④H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1
下列说法合理的是
A.氢气的燃烧热ΔH=-241.6 kJ·mol-1
B.等质量的H2、CO完全燃烧时,CO释放的热量更多
C.煤的气化的热化学方程式为C(s)+H2O(g)=CO(g)+ H2(g) ΔH=-131.1 kJ·mol-1
D.煤炭完全燃烧释放1967.5 kJ热量时转移20 mol电子
科目:高中化学 来源:2016届黑龙江省高三上第三次检测理综化学试卷(解析版) 题型:填空题
大气污染问题日益引起全民关注。
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法 不正确的是_________ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~ 2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
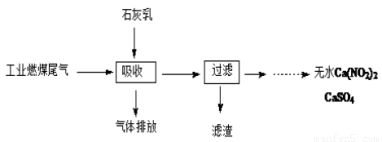
① 硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为________________________ 、_______________ 。
② CaSO4可以调节水泥的硬化时间。尾气中2molSO2被石灰乳逐渐吸收最终生成了1mol CaSO4,该过程中转移的电子数目为_________________________
③ Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式______________________________ 。
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X, 再利用电解法使K2CO3溶液再生,其装置示意图如下: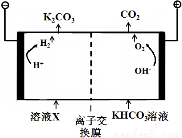
①在阳极区发生的反应包括____________和 H ++ HCO3- = H2O + CO2↑。
②简述CO32-在阴极区再生的原理____________________________ 。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。 已知:25 ℃,101 KPa下: H2(g) + 1/2 O2(g) =H2O(g) Δ H1= -242 kJ/mol
CH3OH(g) + 3/2 O2(g) =CO2 (g) + 2 H2O(g) Δ H2= -676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式________________________ 。
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:选择题
下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:选择题
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
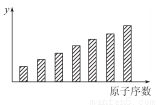
A.y轴表示的可能是基态的原子失去一个电子所需要的最小能量;
B.y轴表示的可能是原子在化合物中吸引电子的能力标度;
C.y轴表示的可能是原子半径;
D.y轴表示的可能是形成基态离子转移的电子数
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3  2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用_____________________(填写仪器或试剂名称);
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_____________________;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥;
(4)如表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7+2NaCl,该反应在溶液中能发生的理由是_____________________;
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量________(填写试剂)、溶解、过滤、再质量分数为________(填写试剂)、…灼烧、冷却、称量,得干燥固体mg.计算祥品中氢氧化铝的________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
鉴别NaCl、NaBr、NaI可以采用的试剂是( )
A.碘水、淀粉溶液 B.碘化钾淀粉溶液 C.溴水、苯 D.氯水、CCl4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是( )
A.Cu2+和Fe2+ B.H+ C.Fe3+和Cu2+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高一上期末化学卷(解析版) 题型:选择题
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高
A.所用NaOH已经潮解 B.定容时俯视
C.未洗涤烧杯及玻璃棒 D.称量时误用“左码右物”
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA
B.在常温常压下,11.2 升氯气含有的分子数为0.5NA
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.1 molFe与足量的Cl2反应转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com