
A、 称量氢氧化钠固体 |
B、 检验铁粉与水蒸气反应产生的氢气 |
C、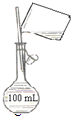 配制150mL 0.10 mol?L-1盐酸 |
D、 分离两种沸点相差较大的液体互溶混合物 |


科目:高中化学 来源: 题型:
| A、铜跟稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| B、硫酸与氢氧化镁混合:H++OH-=H2O |
| C、金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、铜与氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不再变化,可说明达到化学平衡 |
| B、混合气体的颜色不再变化,可说明达到化学平衡 |
| C、达到平衡时,正逆反应仍然在进行 |
| D、若有2mol NO2放入密闭容器中,必生成1mol N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
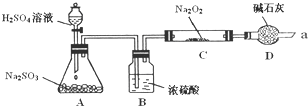 某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应停止了 |
| B、正反应与逆反应的速率都为零 |
| C、反应物和生成物的浓度相等 |
| D、正反应与逆反应的速率相等且大于0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com