
短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
| 乙 | 丙 | 丁 | |
| 甲 | | | 戊 |
(1)第三周期第ⅣA族 (2)> (3)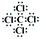 极性
极性
(4)< A B
(5)
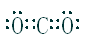
解析试题分析:丁所处的主族序数是其周期序数的三倍,所以丁只能是O,甲、乙、丙、戊分别为Si、C、N、Cl,(1)甲为Si,其在元素周期表中的位置是第三周期第ⅣA族;(2)根据同一周期,原子半径从左往右缩小,可知甲>丁;(3)乙与戊组成化合物为CCl4,其电子式为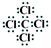 ;化学键的类型为极性共价键;(4)甲为Si,丙为N,所以非金属性是甲<丙,能说明该结论是因为一、丙的氢化物稳定,甲的氢化物不稳定;二、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸,所以答案为 A B。(5)丙的单质为氮气,其电子式为
;化学键的类型为极性共价键;(4)甲为Si,丙为N,所以非金属性是甲<丙,能说明该结论是因为一、丙的氢化物稳定,甲的氢化物不稳定;二、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸,所以答案为 A B。(5)丙的单质为氮气,其电子式为 ;乙与丁的原子构成的三原子分子为二氧化碳,其电子式为
;乙与丁的原子构成的三原子分子为二氧化碳,其电子式为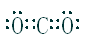 。
。
考点:元素周期表,元素性质
点评:本题考查了元素周期表,元素性质,是高考的考查重点,该题关键是根据丁所处的主族序数是其周期序数的三倍,推断出丁为O,从而推断出其他,该题难度不大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
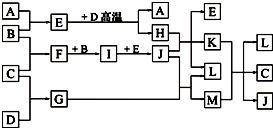 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 最高正价或最低负价 | -4 | +1 | +4 | -2 | -1 |
| A、乙的单质中能与水剧烈反应 |
| B、气态氢化物的稳定性:丙>甲 |
| C、丙的氧化物能与戊的氢化物水溶液反应 |
| D、其最高价氧化物对应的水化物的酸性:丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 |
| A、甲位于元素周期表中第2周期、第ⅤA族 |
| B、原子半径:甲>乙 |
| C、单质的氧化性:丙>乙 |
| D、气态氢化物稳定性:丁>丙>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com