
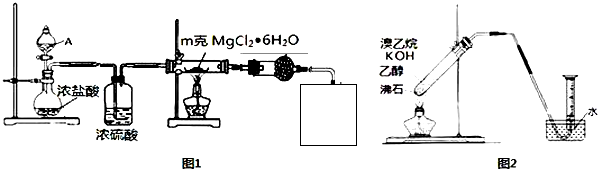
分析 (1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利于HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管,最后连接尾气处理装置.
①氯化氢为有毒气体,需用碱液吸收,防止污染空气,氯化氢极易溶于碱,补充装置需防止倒吸;
②气体的溶解度随着温度的升高而降低,浓硫酸溶于水放入热;
③通过称量加热后固体的质量可以判断氯化镁晶体是否完全分解;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,可以可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热控制反应温度,减少溴乙烷挥发.
解答 解:(1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管,最后连接尾气处理装置.
①氯化氢为有毒气体,防止污染空气,利用氢氧化钠溶液吸收尾气中HCl,且防止倒吸需用倒扣的漏斗,需要补充完整实验装置为: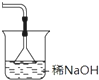 ,
,
故答案为: ;A;
;A;
②由上述分析可知,分液漏斗中的A物质是浓硫酸,
故答案为:浓硫酸;
③实验过程中MgCl2?6H2O未水解,mg晶体的物质的量为$\frac{m}{203}$mol,完全分解得到氯化镁为$\frac{m}{203}$mol×95g/mol=$\frac{95m}{203}$g,称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全,
故答案为:称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石,除浓硫酸、乙醇外,所需的试剂或用品(不包括仪器)有:氢氧化钠溶液、沸石,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;氢氧化钠溶液、沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,
气体产率很低的原因主要是:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;
为增大气体产率,可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热,便于控制温度等,减少溴乙烷挥发,
故答案为:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;增加冷凝回流装置等.
点评 本题考查化学实验制备,属于拼合型题目,明确制备原理是解题关键,侧重考查学生对原理、装置、操作的分析评价,是对学生综合能力的考查,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 11H、21H、31H、H+和H2是氢元素的五种不同粒子 | |
| B. | 白磷和红磷的相互转化属于物理变化 | |
| C. | 11H和21H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | |
| B. | 使用恰当的催化剂能加快反应速率 | |
| C. | 增大N2的浓度能加快反应速率 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,石油经过分馏可制得汽油、乙烯等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
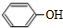
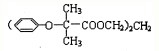 .已知:
.已知: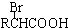 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$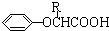
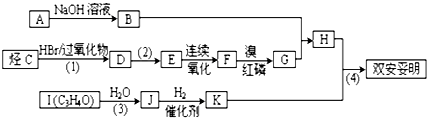
 ,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.
,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.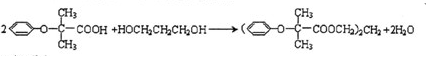 .
.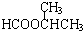 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
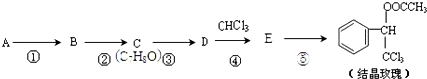
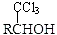 (-R表示烃基)
(-R表示烃基)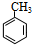 .
.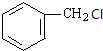 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$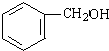 +NaCl.
+NaCl. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2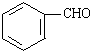 +2H2O.
+2H2O.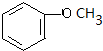 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com