
| A. | 全部 | B. | (2)(3)(4) | C. | (1)(2)(3)(5) | D. | (2)(3)(4)(5) |
分析 (1)有新物质生成的变化属于化学变化,没有新物质生成的变化属于物理变化;
(2)通过比较最高价含氧酸的酸性强弱来比较酸性强弱;
(3)水分子间有氢键;
(4)氢键影响物质的熔沸点;
(5)铵盐是离子化合物.
解答 解:(1)石油裂解是长链烃断裂成乙烯、丙烯等短链烃的加工过程,属于化学变化;煤的气化是煤与碳反应生成一氧化碳和氢气,属于化学变化;溶液是电解,有新物质生成,是化学变化,故正确;
(2)要通过比较最高价含氧酸的酸性强弱来比较酸性强弱,故要比较硫元素的非金属性比氯元素弱,须通过比较H2SO4和HClO4的酸性强弱来比较,故错误;
(3)水分子间有氢键,故使得水的沸点反常的高,故错误;
(4)氢键影响的是物质的熔沸点而不是键能的大小,故错误;
(5)都是由非金属元素形成的化合物不一定是共价化合物,如铵盐,全部由非金属元素构成的,但是离子化合物,故错误.
故选D.
点评 本题考查了金属氧化物和碱性氧化物之间的关系、非金属性的强弱比较、氢键对物质熔沸点的影响等概念难度不大,但概念间的联系是学习的难点,属于易错题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、MnO4-、NO3- | B. | Na+、Ba2+、OH-、CO32- | ||
| C. | Fe2+、H+、SO42-、NO3- | D. | Mg2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构模型演变过程中卢瑟福提出了带核的原子结构模型 | |
| B. | 瑞典化学家舍勒发现了氯气,英国化学家戴维确认了氯气的性质 | |
| C. | 英国化学家戴维首次在实验室制得了金属钠 | |
| D. | 我国化工专家侯德榜发明了向氯化钠饱和溶液中通入CO2制取纯碱的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. |  、 、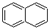 和 和 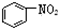 均属于芳香烃 均属于芳香烃 | |
| C. | 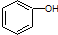 和 和 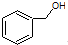 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -867kJ•mol-1 | B. | -574kJ•mol-1 | C. | -691.2kJ•mol-1 | D. | -925.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 浓度均为0.1 mol•L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
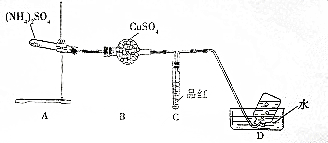
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com