
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | | | |||||
| | | | b | c | d | | |
| e | | f | | | g | | |
(每小题2分,共8分)
(1) 3 IIIA (2分) (2)NaOH+Al(OH)3=NaAlO2+2H2O (2分)
(3) 离子键、共价键 (2分) (4) 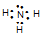 (1分) H2O(1分)
(1分) H2O(1分)
解析试题分析:(3)根据f在元素周期表中的位置可得在第三周期、IIIA;(2)e为钠,最高价氧化物对应的水化物为NaOH,f为铝,最高价氧化物对应的水化物为Al(OH)3,故方程式为:NaOH+Al(OH)3=NaAlO2+2H2O;(3)钠在空气中燃烧生成过氧化钠,钠离子和过氧根离子之间形成离子键,过氧根离子中两个氧原子之间形成共价键;(4)氨气的电子式注意氮原子的孤对电子;同周期从左向右气态氢化物的稳定性逐渐增强,故H2O>NH3。
考点:化学键的判断、元素周期表中元素的判断。元素周期律等知识。


科目:高中化学 来源: 题型:单选题
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,已知HI受热易分解成H2和I2。下列对它的描述中正确的是( )
| A.它是一种共价化合物 |
| B.在加热时此化合物只分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)下表为元素周期表的一部分,期中的编号代表对应的元素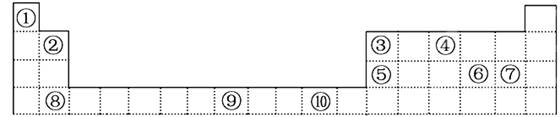
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)写出元素⑨的高价离子的电子排布式_____________________________。
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有________种不同运动状态的电子。该元素在周期表中的位置是上表中相对应的 (填编号),该元素的气态氢化物沸点较高的原因是
(4)⑥、⑦分别①形成的化合物稳定性较强的为 (化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg Al | O S | MgO MgS | H2O H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)氮及其化合物在生产、生活和科技等方面有着重要的应用。请回答下列问题。
(1)氮原子的原子结构示意图为________________________________。
(2)氮气的电子式为________,在氮气分子中,氮原子之间存在着________个σ键和________个π键。
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能________磷原子的第一电离能;
②N2分子中N—N键的键长________白磷分子中P—P键的键长。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 。
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 。简述你的判断依据
。
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体。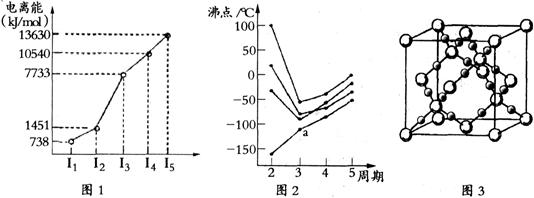
(4)BCl3原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有
种。写出与BCl3结构相同的一种等电子体(写离子) 。
(5)Cu元素形成的单质,其晶体的堆积模型为______,D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是________ (填选项序号)。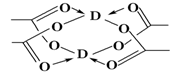
①极性键 ②非极性键 ③配位键 ④金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。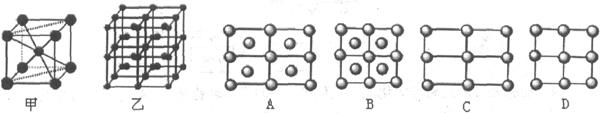
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碱金属元素在科学研究与生产生活中有着非常广泛的用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置: 。
②6.941的意义: __________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图: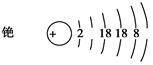
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈, | B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解, | D.其碳酸盐易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下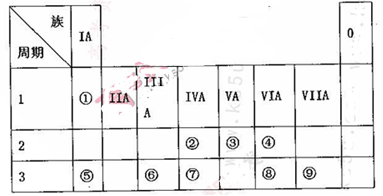
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式 。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com