
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
分析 A、pH=3的醋酸和pH=11的氨水等体积混合后,得到的是醋酸铵溶液,能双水解的盐类;
B、化学反应遵循强酸制备弱酸的原理,据此回答;
C、NaHSO3溶液呈酸性,亚硫酸氢根离子的电离程度大于水解程度;
D、0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中存在物料守恒,据此回答.
解答 解:A、pH=3的醋酸和pH=11的氨水等体积混合后,得到的是醋酸铵溶液,能双水解的盐类,水的电离是被促进的,故A正确;
B、SO32-+2CH3COOH=SO2↑+H2O+2CH3COO-,说明酸性:CH3COOH>H2SO3,这和CH3COOH的Ka=1.8×10-5、H2SO3的Ka1=1.23×10-2亚硫酸酸性强是矛盾的,故B错误;
C、NaHSO3溶液呈酸性,亚硫酸氢根离子的电离程度大于水解程度,而Kw/Ka1>Ka2说明亚硫酸氢根离子的水解程度大于电离程度,故C错误;
D、0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中存在物料守恒2c(Na+)=c(CH3COOH)+c(CH3COO-),存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),整理两式子,得到:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),故D错误.
故选A.
点评 本题考查弱电解质的电离平衡,难度不大,注意电荷守恒、物料守恒、质子守恒三大守恒的应用是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
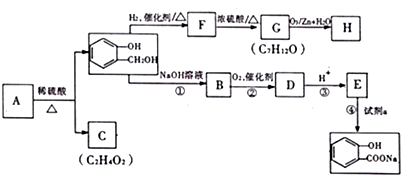
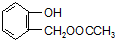 ,C含有的官能团是羧基;由F到G的反应类型为消去反应.
,C含有的官能团是羧基;由F到G的反应类型为消去反应.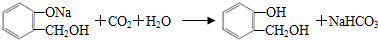 ;合适的试剂a为NaHCO3溶液.
;合适的试剂a为NaHCO3溶液.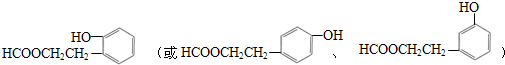 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
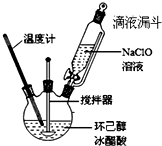 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.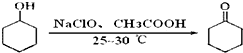
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
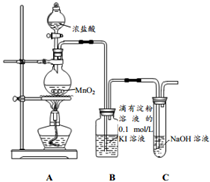 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素构成的单质中一定存在共价键 | |
| B. | 由不同种原子间形成的共价键不一定是极性键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 化学键断裂,不一定发生化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com