
A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A、A、B、E一定在不同周期 B、C的最高价氧化物的水化物可能显碱性
C、A、D可能在同一主族 D、C和D的单质可能化合形成离子化合物
【知识点】元素周期律和元素周期表的综合应用
【答案解析】B 解析:A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A依次减小,B和E同主族,则A在第一周期,为H元素;B在第二周期,E在第三周期,C在第二周期B的后方,D在第三周期E的前方,
A.A在第一周期,B在第二周期,E在第三周期,则一定不在同周期,故A正确;
B.C在第二周期B的后方,且B、E同主族,则C应为非金属元素,C的最高价氧化物的水化物可能显酸性,故B错误;
C.D可能为Na,则A、D可能都在ⅠA族,故C正确;
D.D为金属,C为非金属,C和D的单质可能化合形成离子化合物,故D正确
故答案选B
【思路点拨】本题考查位置、结构、性质,熟悉元素周期表和元素周期律,明确短周期中
IA族和ⅥA族的元素是解答本题的关键,并熟悉元素周期律来解答,难度不大


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
将13.0g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标况)。另取等质量的合金溶于过量的稀硝酸中生成6.72L(标况)NO,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量是
A.11.85g B.12.7g C.27.45g D.28.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
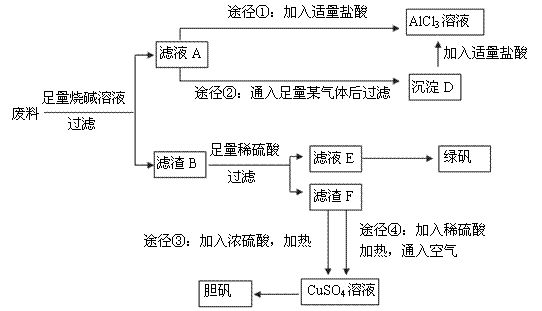
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为较合理的途径及理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了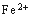 和
和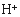 外,还可能存在的微粒 (用元素符号表示)。
外,还可能存在的微粒 (用元素符号表示)。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:
、 。
(5)途径④发生反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A.与W相邻的同主族元素可制成重要的半导体材料
B.X单质不可能置换出W单质
C.元素原子半径从大到小的顺序是X、Y、Z
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高正化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子中,在离核较近的区域内运动的电子能量较高
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是 ( )
A. A、B、C、D、E B. E、C、D、B、A C. B、A、D、C、E D. C、D、A、B、E
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为单质,B与C反应后的产物溶于水得无色酸性溶液。B的水溶液有漂白作用且显酸性,E可作还原剂,其浓溶液用于实验室制B。A、B、C之间的其他反应如图所示:
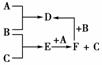
试填空:
(1)写化学式:B________,D________,F________。
(2)鉴别D溶液中阳离子的方法是________________________________。
(3)写出下列反应的离子方程式:
①A+E→F+C:_______________________________________________。
②B+F→D:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有盐酸、硫酸混合液100 mL,向其中加入足量氯化钡溶液,反应完全后,过滤,将沉淀洗涤、烘干,称得沉淀的质量为9.32g。求混合液中硫酸的物质的量浓度为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com