
分析 (1)KHCO3为强碱弱酸盐,碳酸氢根离子水解导致溶液呈碱性;K2SO4为强碱强酸盐,不水解,溶液呈中性;CuCl2是强酸弱碱盐,铜离子水解溶液显酸性;
(2)n(NaHSO4)=0.1L×0.3mol/L=0.03mol/L,n[Ba(OH)2]=0.1L×0.2mol/L=0.02mol,Ba2+完全反应,生成硫酸钡、水、NaOH,反应后溶液显碱性,据此进行解答;
(3)碱抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的氢氧根离子浓度等于溶液中氢离子浓度,K2CO3溶液中水电离出的氢氧根离子浓度为水的离子积常数与氢离子浓度的比.
解答 解:(1)碳酸钾为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为:HCO3-+H2O?H2CO3+OH-;
K2SO4为强碱强酸盐,钾离子和硫酸根离子都不发生水解,所以K2SO4溶液呈中性;
CuCl2是强酸弱碱盐,铜离子水解后溶液呈酸性,水解离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,
故答案为:HCO3-+H2O?H2CO3+OH-;碱;不发生水解;中;Cu2++2H2O?Cu(OH)2+2H+;酸;
(2)100mL0.3mol•L-1的NaHSO4溶液中含有硫酸氢钠的物质的量为:n(NaHSO4)=0.1L×0.3mol/L=0.03mol/L,
100mL0.2mol•L-1的Ba(OH)2溶液中含有氢氧化钡的物质的量为:n[Ba(OH)2]=0.1L×0.2mol/L=0.02mol,
硫酸根离子过量,则Ba2+完全反应,生成硫酸钡、水、NaOH,反应的离子反应为:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O,
反应后溶液显碱性,滴加2~3滴酚酞试液,则溶液的颜色变为红色,
故答案为:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O;红色;
(3)碱抑制水电离,含有弱根离子的盐促进水电离,则25℃时pH=12.0的KOH溶液中水电离出的c(OH-)=c(H+)=1×10-12 mol/L,
K2CO3是强碱弱酸盐,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,所以水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$mol/L=1×10-2 mol/L,
故答案为:1×10-12;1×10-2.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、溶液pH的计算、离子方程式书写等知识,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理及其应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: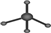 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: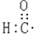 | D. | 甲醛的结构式: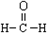 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
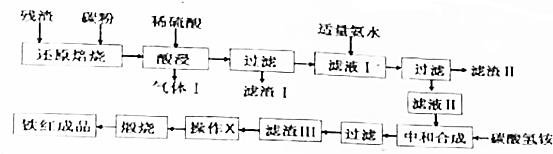
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
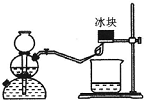 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
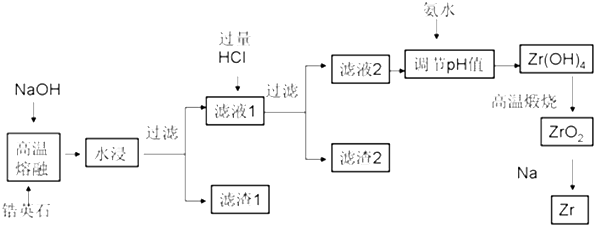
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
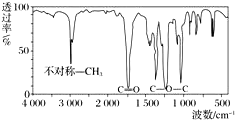 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )| A. | 其化学式为C4H8O2 | |
| B. | 其满足右侧图象的酯有3种 | |
| C. | 鉴定该有机物的结构可用红外光谱或核磁共振氢谱 | |
| D. | 若结构为CH3COOCH2CH3,其核磁共振氢谱中有3个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是负极 | |
| C. | 电子沿导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,锌被硫酸溶解,所以才产生电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com