
【题目】铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、稀盐酸和水洗涤。下列说法不正确的是
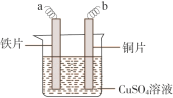
A.稀盐酸的主要作用是除去铁锈
B.a接电源正极,b接电源负极
C.电镀过程中c(Cu2+)基本保持不变
D.阴极发生反应:Cu2++2e– = Cu
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某原子的2p能级电子排布如图![]() ,该图违反了洪特规则
,该图违反了洪特规则
B.在[Ag(NH3)2]+离子中,Ag+给出孤对电子,NH3提供空轨道
C.科学上可以利用原子光谱上的特征谱线鉴定元素
D.基态铜原子的价电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物:
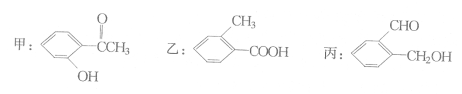
(1)请写出丙中含氧官能团的名称:___________________。
(2)请判别上述哪些有机物互为同分异构体:___________
(3)鉴别乙的方法(指明所选试剂及主要现象即可):__________
(4)请按酸性由强至弱排列甲、乙、丙的顺序:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A对氢气的相对密度为30,分子中含碳40%,含氢6.6%,其余为氧。
(1)通过计算确定该有机物的分子式;____
(2)按中学常见官能团,写出其可能的结构简式。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属在生产生活中的应用十分广泛。
Ⅰ.Cr元素形成的氯化铬酰(CrO2Cl2)有重要用途,在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
(1)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,由以上实验事实可以判断CrO2Cl2分子是_____________(填“极性”或“非极性”)分子,该分子的立体构型的名称为___________。
Ⅱ.Cu可形成多种配合物,根据下列信息回答问题:
(2)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,先后发生的离子方程式为Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+,_______________。
(3)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为__________________________;析出晶体的原因是_______________________________________________________。若将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________________。
(4)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3____H2O(填“大于”、“等于”或“小于”)。
Ⅲ.Ni(CO)6为正八面体结构,其中的镍原子位于正八面体的中心,配位体CO分子则在正八面体的六个顶点上。
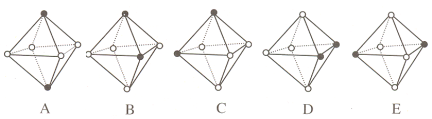
(5)若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是_________。(填字母编号,任填一组。图中黑点为NH3,圆圈为CO,Ni略去)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:
(1)B在周期表中的位置是_________ ; C的元素名称为______.
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是______ (用具体的分子式表示).
(3)A与B形成的三原子分子的结构式是______,B与D形成的原子个数比为1:1的化合物的电子式是______.
(4)写一个由以上5种元素中部分元素形成的物质的发生置换反应的方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为___________________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________________(用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________________________________________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com