
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 先根据化合价的变化判断氧化剂和还原剂,然后根据原子守恒配平方程式,再根据电荷守恒判断n值.
解答 解:该反应中,锰元素的化合价变化为+2价→+7价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以R元素得电子化合价降低,R2O8n-作氧化剂,即Mn2+与R2O8n-的物质的量之比为0.4即2:5,根据各元素的原子守恒写出并配平该方程式为8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,根据电荷守恒得-5n+2×2=-1×2+(-2×10)+1×16,n=2,
故选B.
点评 本题考查氧化还原反应的计算,根据原子守恒和电荷守恒即可分析解答本题,难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 0.1mol/L NH4C1溶液中NH4+的个数为0.1NA | |
| B. | Cu-Zn原电池中,正极产生1.12L H2时,转移的电子数为0.1NA | |
| C. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 一定条件下,28g N2与6gH2反应生成的NH3分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( )
25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( )| A. | 在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ | |
| B. | 在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)>c(Y-)>c(X-) | |
| C. | 在上述NaX和NaY的混合液中存在$\frac{c(HX)}{c({X}^{-})}$=$\frac{c(HY)}{c({Y}^{-})}$ | |
| D. | 在0.2mol•L-1 NaX溶液中加 入等体积0.1mol•L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
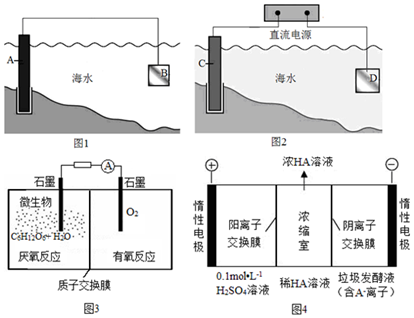
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L | |
| B. | 从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L | |
| C. | 配制500mL 0.1mol/L的CuSO4溶液,需8.0g硫酸铜固体 | |
| D. | 0.1mol/L MgCl2溶液中Cl-浓度为0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com