
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
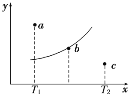
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点:v(正)<v(逆)
【答案】B
【解析】
由反应方程式可知该反应的正反应为气体体积减小的反应。分析所给图示,可以看出随着温度的升高,B的转化率逐渐增大,表示反应向正反应方向进行,则该反应为吸热反应。
A.分析图示曲线的趋势,温度升高,反应正向进行,即正反应是吸热反应,A项错误;
B.b点在平衡曲线上,说明此时可逆反应达平衡状态,对于反应前后气体体积改变的反应,平均摩尔质量不再变化,B项正确;
C.T1温度下若由a点达到平衡,则可逆反应应向逆反应方向移动,增大压强会使该反应向正反应方向移动,不能达到目的,C项错误;
D.c点未处于平衡状态,要达到平衡状态,反应需向正反应方向进行,则v(正)>v(逆),D项错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
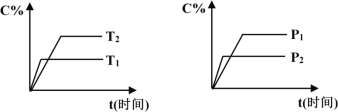
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某浓度的氨水中存在下列平衡:NH3H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是__。(填序号)
NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是__。(填序号)
①适当升高温度②加入NH4Cl固体③通入NH3④通入少量HCl气体
(2)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,产生等量的氢气时,所需要的时间:醋酸_____盐酸(填“>”、“=”或“<”)。
(3)已知电离平衡常数,H2SO3:K1 = 1.54×10-2,K2 = 1.02×10-7;H2CO3:K1 = 4.3×10-7,K2 = 5.6×10-11; CH3COOH:Ka=1.8×105。
① HSO3-的电离平衡常数表达式为:______。
② H2SO3溶液与NaHCO3溶液反应的主要离子方程式为_________。
③在25℃的条件下,向0.1mol·L1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO)=5∶9,此时溶液pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
(1)基态N原子的价电子占据的能量最高的能级是___,价电子在该能级上的排布遵循的原则是__。
(2)除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等物质。而高聚氮结构具有空间网状结构,如图一所示,则N70的沸点___![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 高聚氮的沸点,原因是___;
高聚氮的沸点,原因是___;
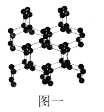
(3)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。与全氮阴离子互为等电子体的一种非极性分子的结构式为___。叠氮化物能形成多种配合物,在[CO(N3)(NH3)5]SO4,其中钴原子的配体是___,SO42-的立体构型为___。
(4)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO3
B.N2H4分子中N原子均采取sp3杂化
C.NaN3的晶格能大于KN3的晶格能
D.纯叠氮酸HN3在常温下是一种液体,是因为分子中存在一种特殊的化学键-氢键
(5)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V形,每个氮原子均达到8电子稳定结构,则阳离子的电子式为___。
(6)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
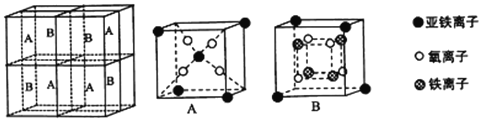
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
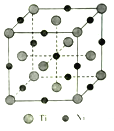
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为____________。
的官能团名称为____________。
(2)已知![]() 的系统命名为2-丙酮酸,则A的名称是 。
的系统命名为2-丙酮酸,则A的名称是 。
(3)D为二元酯,则B→D的化学方程式为 。
(4)D→E的反应历程如下:
![]()
其中属于取代反应的是_________(填序号)![]() 中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
(5)写出满足下列条件的D的所有同分异构体的结构简式 。
a.核磁共振氢谱有4组峰
b.常温下能与NaHCO3按1:2反应并释放出气体
(6)由化合物A经过两步便可以合成环境友好型高聚物聚3-羟基丁酸酯![]() 请写出反应合成线路______________。(无机试剂任用)
请写出反应合成线路______________。(无机试剂任用)
合成线路示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
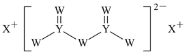
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com