
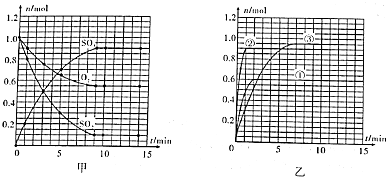
分析 (1)据图可知,SO3在3min时为0.50mol,而容器容积为2L,所以v(SO3)=$\frac{\frac{△n}{V}}{△t}$;
(2)据图可知,第9min时开始达平衡,此时SO2为0.1mol,所以
参加反应的△n(SO2)=(1.0-0.1)mol=0.9mol,转化率=$\frac{参加反应的物质的量}{反应初始物质的量}×100%$;
(3)据图可知,第9min时开始达平衡,SO2为0.1mol,O2为0.55mol,SO3为0.9mol,c(SO2)=$\frac{0.1mol}{2L}$=0.05mol/L、c(O2)=$\frac{0.55mol}{2L}$=0.275mol/L、c(SO3)=$\frac{0.9mol}{2L}$=0.45mol/L,根据化学平衡常数公式计算该温度下的平衡常数;
(4)①改变实验条件后,反应速率加快,平衡时SO3的物质的量小于原平衡的物质的量,说明平衡逆向移动;
②改变实验条件后,平衡时SO3的物质的量与原平衡相同,但速率加快;
③改变实验条件后,平衡时SO3的物质的量大于原平衡的物质的量,平衡正向移动,且速率加快.
解答 解:(1)据图可知,SO3在3min时为0.50mol,而容器容积为2L,所以v(SO3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.50mol}{2L}}{3min}$=0.083mol/(L.min),
故答案为:0.083mol/(L.min);
(2)据图可知,第9min时开始达平衡,此时SO2为0.1mol,所以参加反应的△n(SO2)=(1.0-0.1)mol=0.9mol,转化率=$\frac{参加反应的物质的量}{反应初始物质的量}×100%$=$\frac{0.9mol}{1.0mol}×100%$=90%,故答案为:90%;
(3)据图可知,第9min时开始达平衡,SO2为0.1mol,O2为0.55mol,SO3为0.9mol,c(SO2)=$\frac{0.1mol}{2L}$=0.05mol/L、c(O2)=$\frac{0.55mol}{2L}$=0.275mol/L、c(SO3)=$\frac{0.9mol}{2L}$=0.45mol/L,化学平衡常数K=$\frac{0.45×0.45}{(0.05)^{2}×0.275}$L•mol-1=294.5 L•mol-1,
故答案为:294.5 L•mol-1;
(4)由题目所给图象可知,①改变实验条件后,反应速率加快,平衡时SO3的物质的量小于原平衡的物质的量,说明平衡逆向移动,应为升高温度所致;
②改变实验条件后,平衡时SO3的物质的量与原平衡相同,但速率加快,条件为加入催化剂;
③改变实验条件后,平衡时SO3的物质的量大于原平衡的物质的量,平衡正向移动,且速率加快,故条件应为加压.
故答案为:升高温度;加入催化剂;增大压强.
点评 本题以图象分析为载体考查化学平衡有关计算、化学平衡移动影响因素等知识点,涉及平衡常数的计算、转化率的计算、反应速率计算,根据公式分析解答即可,(4)题要根据反应时间及产物物质的量变化分析解答,题目难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2一甲基一2一丁烯 | B. | 3,3一二甲基一2一丁醇 | ||
| C. | 4一甲基苯酚 | D. | 2,3,4一三甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 结构简式 | 沸点/℃ | 结构简式 | 沸点/℃ |
| CH3CH3 | -88.6 | CH2=CH2 | -103.7 |
| CH3CH2CH3 | -42.2 | CH2=CHCH3 | -47.4 |
| CH3CH2CH2CH3 | -0.5 | CH3CH2CH=CH2 | -6.3 |
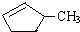
 | -11.7 | 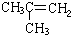 | -6.9 |
| CH3CH2CH2CH2CH3 | 36.1 | CH3CH2CH2CH=CH2 | 30 |
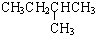 | 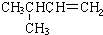 | 20.1 |
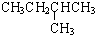 在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).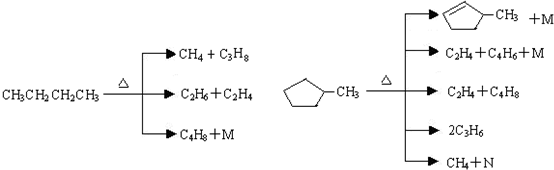
 的说法正确的是A.
的说法正确的是A.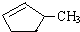 和
和
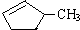 和
和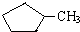 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同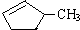 可与水以任意比互溶
可与水以任意比互溶查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的H2和硝酸的物质的量之比为3:1 | |
| B. | 混合物中氧原子的物质的量为0.3mol | |
| C. | 混合物中铁原子的物质的量为0.3mol | |
| D. | 参加反应的硝酸的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
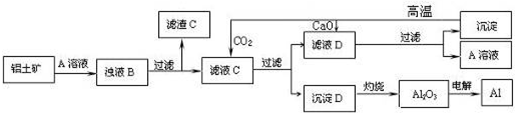
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上将硫酸工业尾气SO2持续通入氨水中:SO2+OH-═HSO3- | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应:2H2O-4e-═O2↑+4H+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com