
【题目】氨是一种重要的致冷剂,原因是( )
A.氨易溶于水B.液氨气化时大量吸收周围的热量,使之温度降低
C.它在常温下是气体D.氨气是共价化合物
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:
【题目】天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示,其中碳元素显﹣2价、氮元素显﹣2价),N2O4作氧化剂,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4 = 3N2↑+ 4H2O↑+ 2CO2↑,下列叙述错误的是( )
A. 燃烧反应放出的巨大能量,把火箭送入太空
B. N2既是氧化产物也是还原产物,CO2是氧化产物
C. 每生成1mol N2,该反应转移电子8mol
D. 此反应中R的分子式为C2H8N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.48gFe3O4完全溶解于100mL1mol/L硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣全部还原为Cr3+ , 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 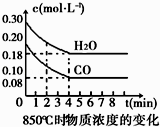
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞是中学阶段常用的酸碱指示剂,己知其结构简式如图所示;下列关于酚酞的说法正确的是( ) 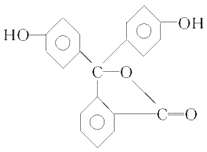
A.酚酞分子中含有两种官能团
B.酚酞的分子式为C20H12O4
C.酚酞属于芳香烃
D.酚酞结构中含有羟基(﹣OH),故酚酞属于醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 0.20 | 0.10 | 1.80 |
C | 1.0 | 0.8 | 1.0 |
D | 0 | 0 | 2.0 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 .
(2)由图1和图2判断使用硫杆菌的最佳条件为 . 若反应温度过高,反应速率下降,其原因是 . 
(3)方法2:在一定条件下,用H2O2氧化H2S
随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为 .
(4)Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)
从平衡移动的角度,简述过程②NaOH再生的原理 .
(5)方法2:用氨水除去SO2
已知25℃,NH3H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的浓度为2.0molL﹣1 , 溶液中的c(OH﹣)=molL﹣1 . 将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 molL﹣1时,溶液中的c(SO32﹣)/c(HSO3﹣)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com