
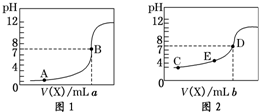
| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |


科目:高中化学 来源: 题型:
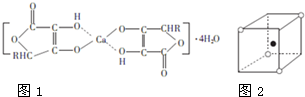 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在干冰晶体中,与一个CO2分子相邻且等距离的CO2分子共有12个 |
| B、在SiO2晶体中,若含有1molSi原子,则Si-O键数为4NA |
| C、在金刚石晶体中,一个碳原子被12个六元碳环所共用,一个C-C键最多可形成6个六元环,一个六元环实际拥有一个碳原子 |
| D、mg石墨中,正六边形数目为m NA/24,每个环拥有碳原子数与C-C键数之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池的电解质溶液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池放电过程中,溶液中的OH-向负极移动 |
| D、电池放电与充电过程发生的化学反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
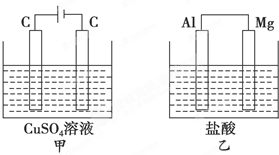 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A、溶液的质量变化:甲减小乙增大 |
| B、溶液pH变化:甲减小乙增大 |
| C、相同条件下产生气体的体积:V甲=V乙 |
| D、电极反应式:甲中阴极为Cu2++2e-═Cu,乙中负极为Mg-2e-═Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑦ | ? | ||||||
| 三 | ① | ③ | ⑤ | ⑥ | ⑧ | ⑩ | ||
| 四 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热的纯溶液清洗油污的原理可表示为:CO3 2-+H2O?HCO3-+OH- |
| B、0.1 mol?L-1的NaHCO3溶液中:K+、Al 3+、Fe3+、NO3- 可大量存在 |
| C、室温下,某溶液中只含有Al 3+、K+、NO3-、SO4 2-,则该溶液由水电离出的c(H+ )=10-13 mol?L-1 |
| D、可以用加热蒸干并充分灼烧的方法得到CuCl2溶液的溶质固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.12mol/(L.s) |
| B、0.36 mol/(L.s) |
| C、0.04 mol/(L.s) |
| D、0.24 mol/(L.s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y一定是非金属元素 |
| B、Y元素与氢元素形成的化合物中只含有极性共价键 |
| C、Y的氧化物都能与NaOH反应 |
| D、Y的最高价氧化物对应的水化物都是H2RO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com