
| ① | ② | ③ | 实验结论或目的 | 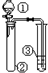 | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | 氯气的水溶液有酸性、漂白性 | |
| B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| C | 硝酸 | Na2CO3溶液 | Na2SiO3溶液 | 比较硝酸、碳酸、硅酸酸性强弱 | |
| D | 溴水 | FeBr3、苯 | AgNO3溶液 | 苯和溴水能发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.新制氯水含盐酸、HClO;
B.稀硫酸与Na2S发生强酸制取弱酸的反应,生成H2S与③中硝酸银反应;
C.浓硝酸易挥发;
D.苯和溴水不反应.
解答 解:A.新制氯水含盐酸、HClO,则向其中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色,可证明,故A正确;
B.稀硫酸与Na2S发生强酸制取弱酸的反应,生成H2S与③中硝酸银反应生成黑色沉淀,不发生沉淀的转化,则不能比较Ksp(AgCl)、Ksp(Ag2S),故B错误;
C.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成,应先除杂,否则不能证明碳酸>硅酸,故C错误;
D.苯和溴水不反应,应用液溴,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氯气的性质、沉淀生成、酸性比较、取代反应等,把握化学反应原理及实验装置中的反应为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Mg能放出H2的溶液K十、Al3+、Cl一、SO42- | |
| B. | 存在较多的H十、SO42-、NO3-的溶液中Fe3+、CH3COO-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:SO32-、NH4+、NO3-、Na+ | |
| D. | 使甲基橙呈红色的溶液NH4+、K+、[Al(OH)4]-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
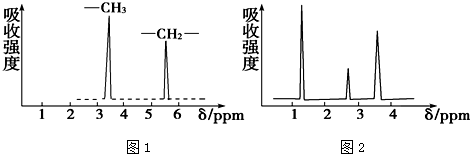
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-NO3- | |
| B. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 使石蕊变蓝的溶液中:Fe2+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 | 离子反应 |
| A | 向FeCl2溶液中加入Zn片 | 浅绿色溶液变为无色 | Zn具有还原性 | Fe2++Zn═Zn2++Fe |
| B | 向FeCl2溶液中滴新制氯水 | 浅绿色溶液变为棕黄色 | Fe2+具有还原性 | 2Fe2++Cl2═2Fe3++2Cl- |
| C | 向FeCl3溶液中加入铁粉 | 棕黄色溶液变为浅绿色 | Fe具有还原性 | Fe+Fe3+═2Fe2+ |
| D | 向FeCl3溶液中加入铜粉 | 蓝色溶液变为棕黄色 | Fe3+具有氧化性 | Fe3++Cu═Fe2++Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
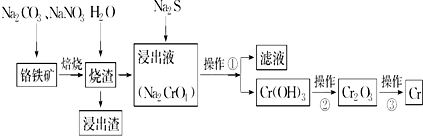
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com