
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
分析 (1)根据化合物中各元素化合价代数和为零分析,可以判断钛元素化合价为+4价;钛铁矿的主要成分为钛酸亚铁(FeTiO3),根据流程可知,钛酸亚铁与稀盐酸反应生成了水和FeTiOCl4;KSCN与Fe3+作用使溶液显血红色,与Fe2+作用无此现象,依此进行分析判断;
(2)向滤液中加入H2O2和NH4H2PO4得到FePO4,过氧化氢氧化亚铁离子,与磷酸根离子形成沉淀,据此分析应采取的正确措施,物质的Ksp越小,越容易形成沉淀;
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,NaH2PO2为正盐,H3PO2为一元酸;一般来说,金属元素与非金属元素形成离子键,同种非金属元素之间形成极性共价键,不同非金属元素之间形成极性共价键;H2C2O4中的碳为+3价,具有还原性;
(4)充电时,为电解池,阳极LiFePO4发生氧化反应;
(5)①用石墨做阳极,碳不断被生成的氧气氧化;②根据钛元素质量守恒计算至少需要该种钛铁矿的质量.
解答 解:(1)钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),铁的化合价为+2价,氧元素的化合价为-2价,设钛元素的化合价为x,根据化合物中各元素化合价的代数和为零的规律,可得+2+x+(-2)×3=0;解之得x=+4,根据工艺流程可知,FeTiO3与稀盐酸反应生成了水和FeTiOCl4,反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,故先滴加KSCN溶液,不显血红色,说明原溶液不含有Fe3+;再加入过氧化氢,溶液显血红色,说明溶液中有Fe3+生成,即过氧化氢氧化亚铁离子,说明原溶液中含有Fe2+,
故答案为:+4;FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O;先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色;
(2)a.FePO4中的铁为+3价铁,加H2O2 目的氧化亚铁离子且不引入新的杂质,不加H2O2 无法氧化得不到FePO4,故a不选;
b.Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol•L-1;Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-38 c(OH-)=1×10-11mol/L,c(H+)=1×10-3mol/L,即PH>3即可形成沉淀,调节溶液pH至5,得到氢氧化铁沉淀,不利于FePO4的生成,故b不选;
c.磷酸为中强酸,降低反应温,不利于NH4H2PO4的电离,不利于FePO4的生成,故c不选;
d.增大NH4H2PO4的用量,增大磷酸根的浓度,有利于FePO4的生成,故d选;
故答案为:d;
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,说明次磷酸中只能电离出一个氢离子,电离方程式为:H3PO2?H++H2PO2-,为一元强酸,在LiFePO4中Li+、Fe2+,与PO43-形成离子键,PO43-中磷和氧形成共价键,H2C2O4中的碳为+3价,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4,将+3价铁还原成+2价的铁,
故答案为:一;离子键、共价键;还原FePO4;
(4)充电时,为电解池,根据部分LiFePO4转化为Li1-xFePO4,可知阳极的电极反应式为:LiFePO4-xe-═Li1-xFePO4+xLi+,
故答案为:LiFePO4-xe-═Li1-xFePO4+xLi+;
(5)①电化学还原TiO2,阳极发生:2O2--4e-═O2↑,C+O2=CO2,碳不断被生成的氧气氧化,因此电解过程中,阳极不断被消耗而需要定期更换,
故答案为:2O2--4e-═O2↑,C+O2=CO2;
②设至少需要该种钛铁矿质量为m,根据钛元素质量守恒,则$\frac{m×80%×1{0}^{3}g}{152g/mol}×76%×48g/mol=12×1{0}^{3}g$,解得m=6.25×104g=62.5kg,
故答案为:62.5.
点评 本题考查了LiFePO4的制取,涉及沉淀溶解平衡、电解池工作原理、化学方程式书写等知识,题目难度中等,注意掌握电解池工作原理,注意把握题中信息,能够正确提取题中信息,联系所学知识进行解答,试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
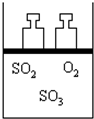 如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | 最高价氧化物对应的碱的碱性:W<X | D. | 最简单氧化物的稳定性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序为:M>W>Z>Y>X | |
| B. | X、Y、Z、W四种元索都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | Y、Z、W、M四种元素与X元素分别形成的最简单化合物的沸点依次升高 | |
| D. | X、M均可与W形成可用于自来水杀菌消毒的强氧化性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com