
| A. | 115号元素衰变成113号元素是化学变化 | |
| B. | 115号元素X的近似相对原子质量为288 | |
| C. | 113号元素的原子最外层有3个电子 | |
| D. | 因115号元素与N元素同主族,所以是非金属元素 |
分析 A.元素的衰变为核变化;
B.质子数=质量数-中子数;
C.112号元素为第七周期第IIB族元素,113号元素位于第ⅢA族;
D.115号元素与N元素位于同一主族,所以位于第ⅤA族,从锑开始为金属元素.
解答 解:A.115号元素衰变成113号元素,为原子核之间的核变化,不是化学变化,故A错误;
B.核素${\;}_{115}^{288}$X的质量数与相对原子质量近似相等,即为288,元素的相对原子质量要根据核素原子质量与丰度进行计算得到,故B错误;
C.112号元素为第七周期第IIB族元素,113号元素位于第ⅢA族,则113号元素最外层有3个电子,故C正确;
D.115号元素与N元素位于同一主族,所以位于第ⅤA族,从锑开始为金属元素,所以115号元素属于金属元素,故D错误;
故选C.
点评 本题考查同一主族元素周期律,明确同一主族元素原子结构及其性质递变规律是解本题关键,侧重考查学生对元素周期表结构及元素周期律知识的掌握及应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
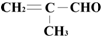 的化学性质叙述正确的是( )
的化学性质叙述正确的是( )| A. | 能发生氧化反应 | |
| B. | 与H2发生加成反应,必定得一种纯的新有机物 | |
| C. | 能发生加聚反应生成高聚物 | |
| D. | 检验-CHO可用酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| B. | 4.6g组成为C2H6O的有机物,C-H键数目可能为0.6NA | |
| C. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| D. | 15g甲基所含有的电子数是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2的漂白原理与SO2的漂白原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com