
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
分析 A.第一主族元素除H外称为碱金属;
B.O、F没有最高正化合价;
C.氢离子核外没有电子,锂离子核外只有2个电子;
D.同主族元素原子最外层电子数相同,化学性质具有相似性,自上而下原子半径增大,化学性质具有递变性.
解答 解:A.H不是碱金属元素,故A错误;
B.主族元素最高正化合价等于其主族族序数,但O、F没有最高正化合价,故B错误;
C.氢离子核外没有电子,锂离子核外只有2个电子,不满足最外层都能达到8电子稳定结构,故C错误;
D.同主族元素原子最外层电子数相同,自上而下原子半径增大,化学性质具有相似性、递变性,化学性质不完全相同,故D正确,
故选D.
点评 本题考查元素周期律与元素周期表的综合应用,难度不大,侧重对基础知识的巩固,注意短周期元素的特殊性.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
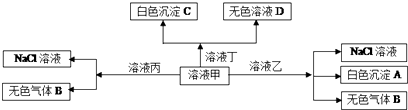
| A. | 甲为AlCl3,乙为NaHCO3 | |
| B. | 在甲中滴加丁开始反应的离子方程式:2HCO3-+Ba2++2OH-B═aCO3↓+2H2O+CO32- | |
| C. | 白色沉淀A不能溶解在溶液丁中 | |
| D. | 在丙中可以大量共存的有:Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
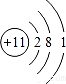 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl中化学键的强度比KCl中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com