
µØ·Æ£ØCuSO4”¤5H2O£©ŹĒĶµÄÖŲŅŖ»ÆŗĻĪļ£¬ÓŠ×Źć·ŗµÄÓ¦ÓĆ”£ŅŌĻĀŹĒCuSO4”¤5H2OµÄŹµŃéŹŅÖʱøĮ÷³ĢĶ¼”£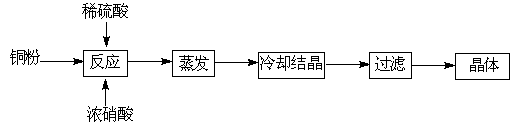
Ķź³ÉĻĀĮŠø÷Ģā£ŗ
¢ń£®£Ø1£©Ļņŗ¬Ķ·ŪµÄĻ”ĮņĖįÖŠµĪ¼ÓÅØĻõĖį£¬Ėę×ÅĶ·ŪµÄČܽāæÉÄܹŪ²ģµ½µÄŹµŃéĻÖĻó ”¢ ”£
£Ø2£©ÖĘµĆµÄµØ·Æ¾§Ģå£ØCuSO4”¤5H2O£©ÖŠæÉÄÜ“ęŌŚµÄŌÓÖŹŹĒ £ØŠ“»ÆѧŹ½£©”£
£Ø3£©²ÉÓĆÖŲĮæ·Ø²ā¶ØCuSO4”¤5H2OµÄŗ¬ĮæŹ±£¬²½ÖčČēĻĀ£ŗ
¢ŁČ”Ńł£¬³ĘĮæ ¢Ś¼ÓĖ®Čܽā ¢Ū¼ÓĀČ»Æ±µČÜŅŗÉś³É³Įµķ ¢Ü¹żĀĖ£ØĘäÓą²½Ö菔ĀŌ£©
ŌŚ¹żĀĖĒ°£¬ŠčŅŖ¼ģŃéŹĒ·ń³ĮµķĶźČ«£¬Ęä²Ł×÷ŹĒ ”£
¢ņ. Ä³ŃŠ¾æŠŌѧĻ°Š”×éÓĆZRY-1ŠĶČČÖŲ·ÖĪöŅĒ¶Ō12.5æĖĮņĖįĶ¾§Ģå(CuSO4”¤5H2O)½ųŠŠČČÖŲ·ÖĪö£¬ĖęĪĀ¶ČµÄÉżøߣ¬ĮņĖįĶ¾§ĢåŅĄ“Ī·¢ÉśĻĀĮŠ·“Ó¦”£
a.CuSO4”¤5H2O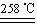 CuSO4£«5H2O
CuSO4£«5H2O
b.CuSO4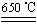 CuO£«SO3”ü£¬2SO3
CuO£«SO3”ü£¬2SO3 2SO2£«O2
2SO2£«O2
c.4CuO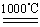 2Cu 2 O£«O2”ü
2Cu 2 O£«O2”ü
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŹµŃé¹ż³ĢÖŠČČÖŲ·ÖĪöŅĒ²āµĆ²ŠĮō¹ĢĢåÖŹĮæĪŖ3.8 g£¬ŹŌĶʶĻøĆ¹ĢĢåµÄ×é·ÖŹĒ (Š“»ÆѧŹ½)£¬Ęä¶ŌÓ¦µÄĪļÖŹµÄĮæÖ®±ČŹĒ ”£
£Ø2£©ČČÖŲ·ÖĪöŅĒ¼ÓČČ¾§ĢåÖĮŗćÖŲŗ󣬽«Č«²æĘųĢåµ¼³ö£¬ĶØČėĒāŃõ»Æ±µČÜŅŗ³ä·Ö·“Ó¦£¬ĖłµĆ³Įµķ¾¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬ÖŹĮæĪŖ g”£
¢ń. £Ø1£©ČÜŅŗ³ŹĄ¶É«”¢ÓŠŗģ×ŲÉ«ĘųĢå²śÉś £Ø2£©Cu(NO3)2
£Ø3£©ŌŚÉĻ²ćĒåŅŗÖŠ¼ĢŠųµĪ¼ÓĀČ»Æ±µČÜŅŗ£¬¹Ū²ģÓŠĪŽ³Įµķ²śÉś,ČōĪŽ£¬Ōņ³ĮµķĶźČ«
¢ņ.£Ø1£©Cu2O”¢CuO£Ø2·Ö£© 1”Ć2£Ø2·Ö£©(±ČÖµŅŖŗĶĒ°Ņ»æÕĪļÖŹ“ĪŠņ¶ŌÓ¦,¼“n(Cu2O):n(CuO£©="1:2" )
£Ø2£©11.65£Ø2·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ¢ń£®£Ø1£©Ļņŗ¬Ķ·ŪµÄĻ”ĮņĖįÖŠµĪ¼ÓÅØĻõĖį£¬ČÜŅŗÖŠ“ęŌŚĒāĄė×ÓŗĶĻõĖįøłĄė×Ó£¬“ĖŹ±Ķ·ŪĻąµ±ÓŚŗĶĻõĖį·¢ÉśĮĖ·“Ó¦£¬¹Ū²ģµ½µÄŹµŃéĻÖĻóČÜŅŗ³ŹĄ¶É«”¢ÓŠŗģ×ŲÉ«ĘųĢå²śÉś”££Ø2£©ÓÉÓŚÖʱøÖŠ“ęŌŚĻõĖįøł£¬ĖłŅŌÖĘµĆµÄµØ·Æ¾§Ģå£ØCuSO4”¤5H2O£©ÖŠæÉÄÜ“ęŌŚµÄŌÓÖŹŹĒ)Cu(NO3)2”££Ø3£©ŅŖ¼ģŃéŹĒ·ń³ĮµķĶźČ«£¬æÉĶعż¼ģŃéĮņĖįøłĄė×ÓŹĒ·ńŗ¬ÓŠ£¬Ęä²Ł×÷ŹĒŌŚÉĻ²ćĒåŅŗÖŠ¼ĢŠųµĪ¼ÓĀČ»Æ±µČÜŅŗ£¬¹Ū²ģÓŠĪŽ³Įµķ²śÉś,ČōĪŽ£¬Ōņ³ĮµķĶźČ«”£¢ņ.£Ø1£©12.5æĖĮņĖįĶ¾§Ģå(CuSO4”¤5H2O)ŹĒ0.05mol£¬Čōֻɜ³ÉŃõ»ÆĶ£¬ŌņĪŖ0.05mol£Ø4g£©£¬²»æÉÄÜ”£Čōֻɜ³ÉŃõ»ÆŃĒĶ£¬ŌņĪŖ0.025mol(3.6g)£¬²»æÉÄÜ£»ĖłŅŌ²ŠĮō3.8 g¹ĢĢåĪŖĮ½Õß»ģŗĻĪļ”£ÉčŃõ»ÆĶŗĶŃõ»ÆŃĒĶĪļÖŹµÄĮæ·Ö±šĪŖxŗĶy£¬ŌņÓŠx+2y=0.05,80x+144y=3.8”£ĒóµĆy:x=1:2”££Ø2£©ČżŃõ»ÆĮņŗĶ¶žŃõ»ÆĮņµÄÉś³ÉĮæÓėĶµÄĪļÖŹµÄĮæĻąĶ¬£¬¼“ĪŖ0.05mol,½«Č«²æĘųĢåµ¼³ö£¬ĶØČėĒāŃõ»Æ±µČÜŅŗ³ä·Ö·“Ó¦£¬ĖłµĆ³ĮµķŹĒĮņĖį±µŗĶŃĒĮņĖį±µ£¬ŃĒĮņĖį±µ×īÖÕ±»Ńõ»ÆĪŖĮņĖį±µ£¬æÉÖŖĮņĖį±µµÄĪļÖŹµÄĮæĪŖ0.05mol,ÖŹĮæĪŖ)11.65g”£
æ¼µć£ŗ±¾Ģāæ¼²é»Æ¹¤Į÷³ĢĶ¼ÖŠµÄĪŹĢā·ÖĪö”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
£Ø±¾Ģā16·Ö£©¢ń.ŹµŃéŹŅ¾³£ŅŖÖĘČ”Ä³ÖÖĘųĢå²¢ŃéÖ¤øĆĘųĢåµÄŠŌÖŹ”£
£Ø1£©ĻĀĮŠ×°ÖĆŹŹŗĻ×÷Ī²ĘųĪüŹÕµÄŹĒ £ØĢīŠņŗÅ£©”£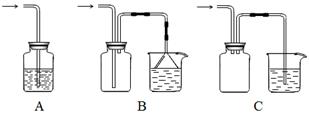
£Ø2£©ĻņĻĀĮŠ×°ÖĆÖŠĶØČėĘųĢåX£¬AÖŠĘ·ŗģČÜŅŗĶŹÉ«£¬ŌņXæÉÄÜŹĒ___________£ØÖĮÉŁĢīĮ½ÖÖ£©Čē¹ūŅŖÖ¤Ć÷XŹĒSO2ĘųĢå,½ÓĻĀĄ“µÄ²Ł×÷ŹĒ£ŗ________________________________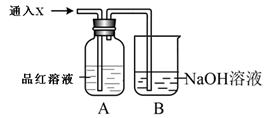
¢ņ.ŹµŃéŹŅÓĆFeSO4ČÜŅŗŗĶNaOHČÜŅŗ·“Ó¦ÖĘČ”Fe(OH)2£¬Č“ŗÜÄŃ擵½ĪČ¶ØµÄ°×É«³Įµķ”£ÓŠĶ¬Ń§Éč¼ĘĮĖŅ»ÖÖŠĀµÄŹµŃé·½·Ø£¬ÄÜĒ峞擵½Éś³É°×É«³Įµķ¼°°×É«³Įµķ×Ŗ»Æ³ÉŗģŗÖÉ«³ĮµķµÄĻÖĻó”£ĒėĶź³ÉŅŌĻĀæÕ°×£ŗ
£Ø1£©Č”Ņ»¶ØĢå»żµÄ0.1mol.L-1NaOHČÜŅŗ·ÅÓŚÉÕ±ÖŠ£¬_________ŗó£¬ŌŁµĪČė¼øµĪÖ²ĪļÓĶ£»
£Ø2£©Ń”Ōń×°ÖĆ___________£ØĢī”°¼×”±»ņ”°ŅŅ”±£©£¬½«£Ø1£©ĖłµĆČÜŅŗ¼ÓČėµ½×°ÖĆÖŠ²¢°“Ķ¼Ź¾×é×°ŗĆ×°ÖĆ”£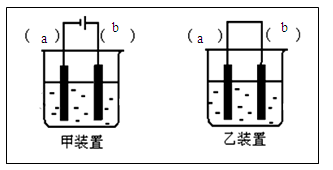
£Ø3£©ŌŚÄćŃ”ŌńµÄ×°ÖĆÉĻ±źĆ÷µē¼«²ÄĮĻ·Ö±šĪŖ____________”¢________________
£Ø4£©ŹµŃéÖŠæÉŌŚ___________擵½ĪČ¶ØµÄ°×É«Fe(OH)2³Įµķ”£
£Ø5£©Čē¹ūŅŖ擵½°×É«³Įµķ×Ŗ»ÆĪŖŗģŗÖÉ«³ĮµķµÄµÄĻÖĻ󣬽ÓĻĀĄ“µÄ²Ł×÷ŹĒ______________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
(12 ·Ö)ĄūÓĆŹÆ»ŅČéŗĶĻõĖį¹¤ŅµµÄĪ²Ęų(ŗ¬NO”¢NO2)·“Ó¦£¬¼ČÄܾ»»ÆĪ²Ęų£¬ÓÖÄÜ»ńµĆÓ¦ÓĆ¹ć·ŗµÄCa(NO2)2£¬Ęä²æ·Ö¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
(1)Ņ»¶ØĢõ¼žĻĀ£¬NO ÓėNO2“ęŌŚĻĀĮŠ·“Ó¦£ŗNO(g)+NO2(g) N2O3(g)£¬ĘäĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK = ”£
N2O3(g)£¬ĘäĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK = ”£
(2)ÉĻŹö¹¤ŅÕÖŠ²ÉÓĆĘų-ŅŗÄęĮ÷½Ó“„ĪüŹÕ(Ī²Ęų“ÓĪüŹÕĖžµ×½ųČė£¬ŹÆ»ŅČé“ÓĪüŹÕĖž¶„ÅēĮÜ)£¬ ĘäÄæµÄŹĒ ;ĀĖŌüæÉŃ»·Ź¹ÓĆ£¬ĀĖŌüµÄÖ÷ŅŖ³É·ÖŹĒ (Ģī»ÆѧŹ½)”£
(3)øĆ¹¤ŅÕŠčæŲÖĘNO ŗĶNO2ĪļÖŹµÄĮæÖ®±Č½Ó½ü1 ŅĆ1”£Čōn(NO)£ŗn(NO2)>1 ŅĆ1£¬Ōņ»įµ¼ÖĀ ;Čōn(NO)£ŗn(NO2)<1 ŅĆ1£¬Ōņ»įµ¼ÖĀ ”£
(4)Éś²śÖŠČÜŅŗŠč±£³ÖČõ¼īŠŌ£¬ŌŚĖįŠŌČÜŅŗÖŠCa(NO2)2»į·¢Éś·Ö½ā£¬²śĪļÖ®Ņ»ŹĒNO£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
³£ĪĀ³£Ń¹ĻĀ£¬O3ĪŖµĄ¶É«ÓŠĢŲŹā³ōĪ¶µÄĘųĢ壬¹¤ŅµÉĻ³£ÓĆO3×÷ĪŖŌģÖ½”¢·ÄÖÆµČŠŠŅµµÄĘÆ°×ŗĶĶŃÉ«¼Į£¬Ņ²æÉÓĆ×÷ŅūÓĆĖ®µÄĻū¶¾ŗĶɱ¾ś¼Į£¬µ«O3ÅØ¶Č³¬±źŹ±»įŅņĘäĒæŃõ»ÆŠŌ¶ų¶ŌČĖĢå²śÉś¶¾ø±×÷ÓĆ”£×ŌČ»Ģõ¼žĻĀ“ņĄ×Ź±æÕĘųÖŠ»įÓŠ²æ·ÖO2×Ŗ»ÆĪŖO3”£
ŹµŃéŹŅĻÖĢį¹©ŅŌĻĀ×°ÖĆŗĶŅ©Ę·£¬ĒėÄćĶź³ÉO3µÄÖʱø¼°ŠŌÖŹŃéÖ¤ŹµŃ锣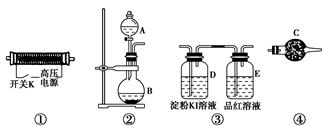
Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
(1)ŅŌÉĻ×°ÖƵÄĮ¬½ÓĖ³ŠņĪŖ______½Ó______½Ó________½Ó________”£
(2)A֊ӦװČėµÄŹŌ¼ĮĪŖ________(Š“»ÆѧŹ½)£»BÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ____________________________________________________”£
(3)¼ģŃéÕūøö×°ÖƵÄĘųĆÜŠŌµÄ¾ßĢå²Ł×÷ŹĒ__________________________”£
(4)ŹµŃéæŖŹ¼Ź±£¬Č”ĻĀ·ÖŅŗĀ©¶·µÄČū×Ó£¬¶ĻæŖµēŌ“æŖ¹ŲK£¬ŌŁŠżæŖ·ÖŅŗĀ©¶·µÄ»īČū£¬³ÖŠųĶØČėĘųĢåŅ»¶ĪŹ±¼ä£¬ĘäÄæµÄŹĒ________”¢________”£Č»ŗóŗĻÉĻµēŌ“æŖ¹ŲK£¬ŹŌŌ¤²āĻĀĮŠ×°ÖĆÖŠæÉÄܹŪ²ģµ½µÄĻÖĻó¼°¶ŌÓ¦µÄ½įĀŪ”£
D×°ÖĆÖŠ£ŗ___________________________________________________£»
E×°ÖĆÖŠ£ŗ____________________________________________________”£
(5)ĒėÖø³öøĆŹµŃé×°ÖĆÖŠµÄ²»Ķ×Ö®“¦²¢øĽų£ŗ_________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
µ„¾§¹čŹĒŠÅĻ¢²śŅµÖŠÖŲŅŖµÄ»ł“”²ÄĮĻ”£¹¤ŅµÉĻæÉÓĆ½¹ĢæÓė¶žŃõ»Æ¹čµÄ»ģŗĻĪļŌŚøßĪĀĻĀÓėĀČĘų·“Ӧɜ³ÉSiCl4ŗĶCO£¬SiCl4¾Ģį“æŗóÓĆĒāĘų»¹ŌµĆøß“æ¹č”£ŅŌĻĀŹĒŹµŃéŹŅÖʱøSiCl4µÄ×°ÖĆŹ¾ŅāĶ¼”£
ŹµŃé¹ż³ĢÖŠ£¬ŹÆӢɰ֊µÄĢś”¢ĀĮµČŌÓÖŹŅ²ÄÜ×Ŗ»ÆĪŖĻąÓ¦ĀČ»ÆĪļ£¬SiCl4”¢AlCl3”¢FeCl3ÓöĖ®¾łŅ×Ė®½ā £¬ÓŠ¹ŲĪļÖŹµÄĪļĄķ³£Źż¼ūĻĀ±ķ£ŗ
£¬ÓŠ¹ŲĪļÖŹµÄĪļĄķ³£Źż¼ūĻĀ±ķ£ŗ
| ĪļÖŹ | SiCl4 | AlCl3 | FeCl3 |
| ·Šµć/”ę | 57.7 | £ | 315 |
| ČŪµć/”ę | -70.0 | £ | £ |
| Éż»ŖĪĀ¶Č/”ę | £ | 180 | 300 |
 £Ø2£©×°ÖĆCÖŠµÄŹŌ¼ĮŹĒ £» D”¢E¼äµ¼¹Ü¶ĢĒŅ“ÖµÄŌŅņŹĒ ”£
£Ø2£©×°ÖĆCÖŠµÄŹŌ¼ĮŹĒ £» D”¢E¼äµ¼¹Ü¶ĢĒŅ“ÖµÄŌŅņŹĒ ”£ £Ø3£©GÖŠĪüŹÕĪ²ĘųŅ»¶ĪŹ±¼äŗó£¬ĪüŹÕŅŗÖŠæĻ¶Ø“ęŌŚOH£”¢Cl£ŗĶSO42-”£ĒėÉč¼ĘŹµŃ飬Ģ½¾æøĆĪüŹÕŅŗÖŠæÉÄÜ“ęŌŚµÄĘäĖūĖįøłĄė×Ó£ØŗöĀŌæÕĘųÖŠCO2µÄÓ°Ļģ£©”£
£Ø3£©GÖŠĪüŹÕĪ²ĘųŅ»¶ĪŹ±¼äŗó£¬ĪüŹÕŅŗÖŠæĻ¶Ø“ęŌŚOH£”¢Cl£ŗĶSO42-”£ĒėÉč¼ĘŹµŃ飬Ģ½¾æøĆĪüŹÕŅŗÖŠæÉÄÜ“ęŌŚµÄĘäĖūĖįøłĄė×Ó£ØŗöĀŌæÕĘųÖŠCO2µÄÓ°Ļģ£©”£| ŠņŗÅ | ²Ł ×÷ | æÉÄܳöĻÖµÄĻÖĻó | ½įĀŪ |
| ¢Ł | ĻņaŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ | ČōČÜŅŗĶŹÉ« | Ōņ¼ŁÉč1³ÉĮ¢ |
| ČōČÜŅŗ²»ĶŹÉ« | Ōņ¼ŁÉč2»ņ3³ÉĮ¢ | ||
| ¢Ś | ĻņbŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ | ČōČÜŅŗĶŹÉ« | Ōņ¼ŁÉč1»ņ3³ÉĮ¢ |
| ČōČÜŅŗ²»ĶŹÉ« | ¼ŁÉč2³ÉĮ¢ | ||
| ¢Ū | ĻņcŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ | | ¼ŁÉč3³ÉĮ¢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
Ńõ»Æ¶žĀČŹĒ×Ų»ĘÉ«“Ģ¼¤ŠŌĘųĢ壬ČŪµć£ŗ©116”ę£¬·Šµć3.8”ę£®Ńõ»Æ¶žĀČ²»ĪČ¶Ø£¬½Ó“„Ņ»°ćÓŠ»śĪļŅ×±¬ÕØ£»ĖüŅ×ČÜÓŚĖ®£Ø1£ŗ100£©£¬Ķ¬Ź±·“Ӧɜ³É“ĪĀČĖįČÜŅŗ£»Öʱø³öÖ®ŗóŅŖĄäČ“³É¹ĢĢ¬ŅŌ±ć²Ł×÷ŗĶÖü“ę£®ÖʱøÉŁĮæCl2O£¬ŹĒÓĆøÉŌļµÄĀČĘųŗĶHgO·“Ó¦£Ø»¹Éś³ÉHgO?HgCl2£©£®×°ÖĆŹ¾ŅāČēĶ¼£ØĢś¼ÜĢØŗĶ¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£©£®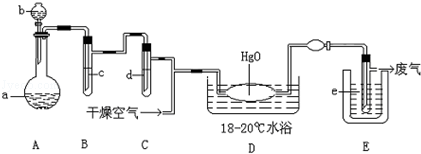
£Ø1£©AÖŠŹ¢ÓŠµÄÉīÉ«¹ĢĢåŹŌ¼ĮaŹĒ”” ””£¬·ÖŅŗĀ©¶·ÖŠŹŌ¼ĮbŹĒ ””””
£Ø2£©BÖŠŹ¢ÓŠŅŗĢåcŹĒ”” ””£¬CÖŠµÄŅŗĢådŹĒ”” ””
£Ø3£©DÖŠĖł·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ”” ””
£Ø4£©EÖŠµÄ±£ĪĀĘæÖŠŹ¢ÓŠÖĀĄä¼Į£¬ĖüÓ¦ŹĒ”” ””£ØŌŚøɱł”¢±łĖ®”¢ŅŗĢ¬æÕĘųÖŠŃ”Ōń£©£¬ŌŚEµÄÄŚ¹ÜµĆµ½µÄŃõ»Æ¶žĀČÖŠæÉÄÜŗ¬ÓŠŌÓÖŹŹĒ”” ””
£Ø5£©×°ÖĆA”¢B”¢C¼äµÄĮ¬½Ó·½Ź½ÓėD”¢E¼äµÄĮ¬½Ó·½Ź½ÓŠĆ÷ĻŌµÄĒų±š£¬ÕāĒų±šŹĒ”” ””£¬ÓĆÕāŠ©²»Ķ¬µÄĮ¬½Ó·½Ź½µÄÖ÷ŅŖĄķÓÉŹĒ”” ””£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
ÄÉĆ×Ģ¼ĖįøĘ¹ć·ŗÓ¦ÓĆÓŚĻš½ŗ”¢ĖÜĮĻ”¢ŌģÖ½”¢»Æѧ½Ø²Ä”¢ÓĶÄ«”¢ĶæĮĻ”¢ĆÜ·ā½ŗÓė½ŗÕ³¼ĮµČŠŠŅµ”£ŌŚÅØCaCl2ČÜŅŗÖŠĶØČėNH3ŗĶCO2£¬æÉŅŌÖʵĆÄÉĆ×¼¶Ģ¼ĖįøĘ”£Ä³Š£Ń§ÉśŹµŃ銔×éÉč¼ĘĻĀĶ¼ĖłŹ¾×°ÖĆ£¬ÖĘČ”øĆ²śĘ·”£D֊װӊÕŗĻ”ĮņĖįµÄĶŃ֬Ǝ£¬Ķ¼ÖŠ¼Š³Ö×°ÖĆŅŃĀŌČ„”£
¢ń£®æÉŃ”ÓƵÄŅ©Ę·ÓŠ£ŗ
a£®ŹÆ»ŅŹÆ£»b£®±„ŗĶĀČ»ÆøĘČÜŅŗ£»c£®6 mol/LŃĪĖį£»d£®ĀČ»Æļ§£»e£®ĒāŃõ»ÆøĘ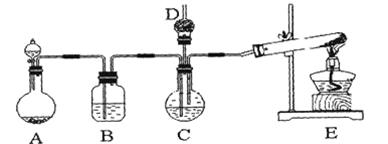
£Ø1£©AÖŠÖʱøĘųĢåŹ±£¬ĖłŠčŅ©Ę·ŹĒ£ØŃ”Ģī×ÖÄøŠņŗÅ£© £»
£Ø2£©BÖŠŹ¢ÓŠ±„ŗĶĢ¼ĖįĒāÄĘČÜŅŗ£¬Ęä×÷ÓĆŹĒ £»
£Ø3£©Š“³öÖĘČ”°±ĘųµÄ»Æѧ·½³ĢŹ½ £»
£Ø4£©ŌŚŹµŃé¹ż³ĢÖŠ£¬ĻņCÖŠĶØČėĘųĢåŹĒÓŠĻČŗóĖ³ŠņµÄ£¬Ó¦ĻČĶØČėĘųĢåµÄ»ÆѧŹ½ £»
£Ø5£©¼ģŃéD³öæŚ“¦ŹĒ·ńÓŠ°±ĘųŅŻ³öµÄ·½·ØŹĒ £»
£Ø6£©Š“³öÖĘÄÉĆ×¼¶Ģ¼ĖįøʵĻÆѧ·½³ĢŹ½ ”£
£Ø7£©ČōŹµŃé¹ż³ĢÖŠÓŠ°±ĘųŅŻ³ö£¬Ó¦Ń”ÓĆĻĀĮŠ ×°ÖĆ»ŲŹÕ£ØĢī“śŗÅ£©”£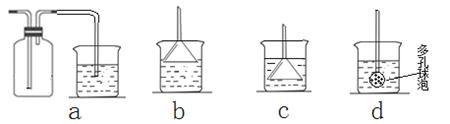
¢ņ£®¾·ÖĪöŌŚÉĻŹöĀČ»Æļ§ŃłĘ·ÖŠŗ¬ÓŠŌÓÖŹĢ¼ĖįĒāÄĘ”£ĪŖĮĖ²ā¶ØĀČ»Æļ§µÄÖŹĮæ·ÖŹż£¬øĆѧɜŹµŃ銔×éÓÖÉč¼ĘĮĖČēĻĀŹµŃéĮ÷³Ģ£ŗ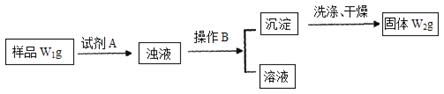
ŹŌ»Ų“š£ŗ
£Ø1£©Ėł¼ÓŹŌ¼ĮAµÄ»ÆѧŹ½ĪŖ
£Ø2£©B²Ł×÷·½·ØŹĒ
£Ø3£©ŃłĘ·ÖŠĀČ»Æļ§µÄÖŹĮæ·ÖŹżĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
Ńõ»ÆŃĒĶŹĒ“óŠĶĖ®Ćę½¢“¬·Ą»¤Ķæ²ćµÄÖŲŅŖŌĮĻ”£Ä³Š”×é½ųŠŠČēĻĀŃŠ¾æ£¬ĒėĢīŠ“ĻĀĮŠæÕ°×”£
ŹµŃé1£ŗŃõ»ÆŃĒĶµÄÖĘČ”Ńõ»ÆŃĒĶæÉÓĆĘĻĢŃĢĒŗĶŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ·“Ó¦ÖĘČ””£ĪÄĻ×±ķĆ÷£¬Ģõ¼žæŲÖĘ²»µ±Ź±»įÓŠÉŁĮæCuOÉś³É”£
£Ø1£©ŹµŃéŹŅÖĘČ”ĒāŃõ»ÆĶŠü×ĒŅŗµÄĄė×Ó·½³ĢŹ½ĪŖ____________”£
£Ø2£©ŹµŃéŹŅÓĆ“Ė·½·ØÖĘČ”²¢»ńµĆÉŁĮæŃõ»ÆŃĒĶ¹ĢĢ壬ŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠŹŌ¹Ü”¢¾Ę¾«µĘ”¢ÉÕ±____________ŗĶ____________”£
£Ø3£©ČōŅŖĢ½¾æøĆ·“Ó¦·¢ÉśµÄ×īµĶĪĀ¶Č£¬Ó¦Ń”ÓĆµÄ¼ÓČČ·½Ź½ĪŖ____________”£
ŹµŃé2£ŗ²ā¶ØŃõ»ÆŃĒĶµÄ“æ¶Č
·½°ø1£ŗ³ĘČ”ŹµŃé1ĖłµĆ¹ĢĢåm g£¬²ÉÓĆČēĻĀ×°ÖĆ½ųŠŠŹµŃ锣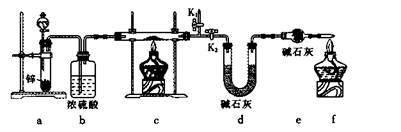
£Ø4£©×°ÖĆaÖŠĖł¼ÓµÄĖįŹĒ____________£ØĢī»ÆѧŹ½£©”£
£Ø5£©Ķعż²ā³öĻĀĮŠĪļĄķĮ棬ÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ____________”£
| A£®·“Ó¦Ē°ŗó×°ÖĆaµÄÖŹĮæ |
| B£®×°ÖĆc³ä·Ö·“Ó¦ŗóĖłµĆ¹ĢĢåµÄÖŹĮæ |
| C£®·“Ó¦Ē°ŗó×°ÖĆdµÄÖŹĮæ |
| D£®·“Ó¦Ē°ŗó×°ÖĆeµÄÖŹĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
¹¤ŅµÉĻÓĆĀĮĶĮæó£ØÖ÷ŅŖ³É·ÖĪŖAl2O3£¬ŗ¬SiO2”¢Fe2O3µČŌÓÖŹ£©ĪŖŌĮĻŅ±Į¶ĀĮµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£¬¶ŌĻĀŹöĮ÷³ĢÖŠµÄÅŠ¶ĻÕżČ·µÄŹĒ£ŗ
| A£®ŹŌ¼ĮXĪŖĻ”ĮņĖį£¬³ĮµķÖŠŗ¬ÓŠ¹čµÄ»ÆŗĻĪļ |
| B£®·“Ó¦IIÖŠÉś³ÉAl£ØOH£©3µÄ·“Ó¦ĪŖ£ŗCO2+AlO2-+2H2OØTAl£ØOH£©3”ż+HCO3- |
| C£®½įŗĻÖŹ×Ó£ØH+£©µÄÄÜĮ¦ÓÉČõµ½ĒæµÄĖ³ŠņŹĒOH-£¾CO32-£¾AlO2- |
| D£®Al2O3ČŪµćŗÜøߣ¬¹¤ŅµÉĻ»¹æɲÉÓƵē½āČŪČŚAlCl3Ņ±Į¶Al |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com