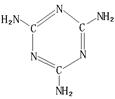
Ⅰ.甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同。

已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、己三种粒子均含有等量的总电子数,其中丙、己是同一类晶体中的分子,己在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体),戊通常为气体与丙结构相似,但分子中多了24个价电子。
(1)写出液态己产生两种等电子粒子的电离方程式:
。
(2)X、Y原子的最外层都满足8电子的分子是
(填字母代号)
A.甲 B.乙 C.丙 D.戊 E.己
(3)写出甲与乙发生置换反应的反应方程式:
。
(4)丙是目前重要的能源之一。
①丙和己在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是:
。
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为
。
(5)请写出一种与戊符合“等电子原理”的离子
。
Ⅱ.A 、B 、C 、D 、E 五种短周期元素,原子序数依次增大.A、D同主族,A 与B 、C 分别构成电子数相等的化合物w、k,且w是一种能产生温室效应的气体;D 元素最外层电子数是次外层电子数的3 倍;A 、B 、C 、D 可形成化合物x;A 、D 、E 可形成化合物y;A 、C 、D 可形成化合物z.x、y、z 均为阳离子和阴离子个数比是1 : 1 的离子化合物.回答下列问题:
(1)y的电子式为_________________;w属于______ (填“极性”或“非极性)分子;
(2)与E 同主族且为第七周期的元素原子序数为_________________;
(3)在同主族氢化物的性质递变中,k 的沸点反常,这可以用__________来解释(填字母序号);
A.共价健 B.离子键 C.氢键 D.范德瓦耳斯力
(4)常温下,x 与y以物质的量之比1 : 2 反应后所得溶液显_______(填“酸”、“碱”或“中”)性,由产物分析,原因是________________________(用离子方程式表示);
(5)由k与D 的单质、KOH 溶液构成原电池,负极会产生C 的单质。则其负极反应为______________________________;一段时间后,溶液pH__________(填“增大”、“减小”或“不变” )。

 键。
键。