
| A. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| B. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
分析 A.俯视滴定管的刻度,造成V(碱)偏小;
B.乙酸可与氢氧化铜发生中和反应,葡萄糖含有醛基,可与氢氧化铜浊液发生氧化还原反应,淀粉与新制氢氧化铜悬浊液不反应;
C.二氧化硫在水中溶解度较大,应该通过观察生成沉淀的快慢判断浓度对反应速率的影响;
D.受酸腐蚀应该涂弱碱性物质.
解答 解:A.滴定终点读数时,俯视滴定管的刻度,造成V(标准碱)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(酸)偏小,故A正确;
B.葡萄糖含有醛基,可与氢氧化铜浊液发生氧化还原反应生成砖红色沉淀,乙酸可与氢氧化铜发生中和反应蓝色絮状沉淀溶解,淀粉与新制氢氧化铜悬浊液不反应,现象不同,可鉴别,故B正确;
C.二氧化硫易溶于水,若验证浓度对反应速率的影响,应该比较不同浓度Na2S2O3溶液与稀硫酸反应溶液变浑浊的快慢分析,故C错误;
D.受酸腐蚀应涂碳酸氢钠,而不是酸,故D错误;
故选CD.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及滴定误差分析、醛基的检验、二氧化硫性质、危险处理等知识,侧重于学生的分析能力和实验能力的考查,注意相关知识的学习与积累.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: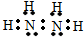 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
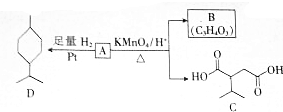
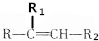 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$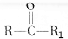 +R2COOH
+R2COOH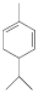 .A与等物质的量的溴单质反应的产物有3种.
.A与等物质的量的溴单质反应的产物有3种. +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
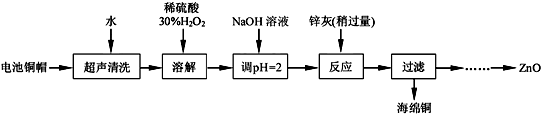
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol•(L•min) -1 | B. | 18mol•(L•min)-1 | C. | 0.6mol•(L•min) -1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com