
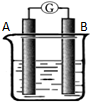
 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
分析 (1)第1组实验中金属镁的活泼性强于金属铝,镁可以和所以金属镁是负极,正极上是氢离子得电子的还原反应,将烧杯中的液体换为NaOH溶液,金属镁和氢氧化钠之间不反应,所以金属镁是正极,金属铝是负极,在负极上是金属铝失电子的氧化反应;
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极上是燃料氢气失电子的氧化反应,据电极反应判断;
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,构成CO燃料电池,在正极上是氧气得电子的还原反应;
(4)原电池中正负极反应之和即为总反应,该电池工作时,消耗1mol硫酸根离子,正极上质量增加64g,根据电极反应计算.
解答 解:(1)金属镁的活泼性强于金属铝,镁可以和所以金属镁是负极,正极上是氢离子得电子的还原反应,将烧杯中的液体换为NaOH溶液,金属镁和氢氧化钠之间不反应,所以金属镁是正极,金属铝是负极,在负极上是金属铝失电子的氧化反应,电极反应为:2Al+8OH--6e-=2AlO2-+4H2O;
故答案为:Mg;2H++2e-=H2↑;Al;2Al+8OH--6e-=2AlO2-+4H2O;
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极上是燃料氢气失电子的氧化反应,电极反应式为:2H2+4OH--4e-=4H2O;正极上是氧气得电子的还原反应,即O2+4e-+2H2O,4OH-,所以该电极附近碱性增加,pH变大.故答案为:2H2+4OH--4e-=4H2O;变大;
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,构成CO燃料电池,在正极上是氧气得电子的还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-;
(4)总反应方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为Pb-2e-+SO42-=PbSO4,正负极反应之和即为总反应,则正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O;该电池工作时,消耗1mol硫酸根离子,正极上质量增加64g,如果正极材料质量增加96克,即消耗硫酸根离子是1.5mol,理论上在外电路通过得电子数目为3NA或1.806×1024.故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;3NA或1.806×1024.
点评 本题考查原电池原电池工作原理,题目难度中等,注意掌握原电池工作原理,明确尽管镁比铝活泼,但在碱性介质中铝为负极,为易错点


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀氨水和Al2(SO4)3 | B. | 稀盐酸和Na2CO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
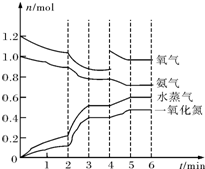 在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )
在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )| A. | 充入了O2(g) | B. | 降低温度 | C. | 加了催化剂 | D. | 扩大了容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些燃料褪色 | ||
| C. | 二氧化硫使溴水褪色 | D. | 活性炭使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 | |
| B. | 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 | |
| C. | 凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 | |
| D. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭与新制氯水的漂白原理相同 | |
| B. | 过氧化钠常用于羽绒制品的漂白 | |
| C. | 漂白粉是由Ca(ClO)2组成的纯净物 | |
| D. | 将漂白剂SO2和NaClO混合使用可增加漂白效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com