
 如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:分析 (1)由图象可知A、B的浓度降低,A、B为反应物,C的浓度增大为生成物,根据A、B、C的浓度变化量确定化学计量数,据此书写方程式;
(2)根据V=$\frac{△c}{△t}$进行计算;
(3)(t1+10)s 时,平衡没有发生移动,据A的转化率为$\frac{转化量}{起始量}$×100%计算;
(4)a.到达t1时刻该反应达平衡但没有停止;
b.在t1时刻之前,反应向正反应方向移动,据此判断;B气体的消耗速率大于它的生成速率
c.在t1时刻达平衡,正逆反应速率相等;C气体的正反应速率等于逆反应速率
(5)根据压强之比等于物质的量之比进行计算.
解答 解:(1)由图象可知A、B的浓度降低,A、B为反应物,A的浓度变化量为0.8mol/L-0.2mol/L=0.6mol/L,B的浓度变化量为0.5mol/L-0.3mol/L=0.2mol/L,C的浓度增大为生成物,C的浓度变化量为0.4mol/L,浓度变化量之比等于化学计量数之比,故A、B、C的化学计量数之比为0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,故反应方程式为:3A+B?2C;故答案为:3A+B?2C;
(2)0~t1s 内B气体的平均反应速率V=$\frac{△c}{△t}$=$\frac{0.5-0.3}{t{\;}_{1}}$=$\frac{0.2}{t{\;}_{1}}$mol/(L•s),故答案为:$\frac{0.2}{t{\;}_{1}}$mol/(L•s);
(3)(t1+10)s 时,平衡没有发生移动,所以A的转化率为$\frac{0.8-0.2}{0.8}$×100%=75%,此时v(A)正=v(A)逆=3v(B)逆,所以v(A)正>v(B)逆,故答案为:75%;>;
(4)a.到达t1时刻该反应达平衡但没有停止,故错误;
b.在t1时刻之前,反应向正反应方向移动,所以B气体的消耗速率大于它的生成速率,故正确;
c.在t1时刻达平衡,正逆反应速率相等,所以C气体的正反应速率等于逆反应速率,故正确;
故选:bc;
(5)因为压强之比等于物质的量之比,所以容器中(t1+10)s时的压强与起始时的压强之比为$\frac{0.4+0.3+0.2}{0.8+0.5}$=9:13,故答案为:9:13.
点评 本题考查平衡图象、化学平衡有关计算、平衡状态的判断等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
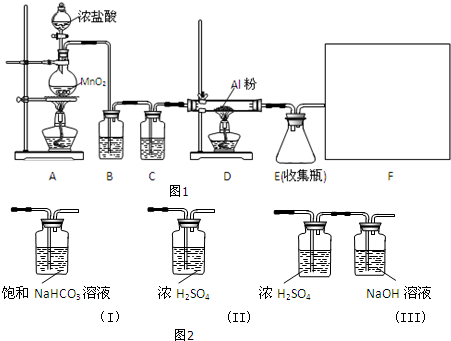
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
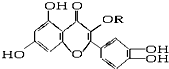 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 | |
| B. | 可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 | |
| C. | 一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA | |
| B. | 14g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 1mol任何物质所含的分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有Br2,将其倒入NaOH溶液中,振荡,静置,分液 | |
| B. | 乙烷中混有乙烯,在一定条件下通入足量的氢气进行反应,使乙烯转化为乙烷 | |
| C. | 乙酸乙酯中混有乙酸,可加入一定量的乙醇,在浓硫酸存在的条件下加热使乙酸酯化 | |
| D. | 乙烯中混有SO2和CO2,将其通入溴水进行洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com