
| O | 2- 3 |
| O | - 3 |
| O | - 4 |
| O | 2- 3 |
2- 3 |
- 3 |
| O | 2- 4 |
2- 4 |
- 4 |
2- 3 |
2- 3 |
2- 4 |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、①② | B、②③④ |
| C、②③⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
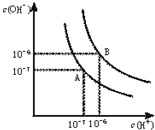 (1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从查看答案和解析>>
科目:高中化学 来源: 题型:
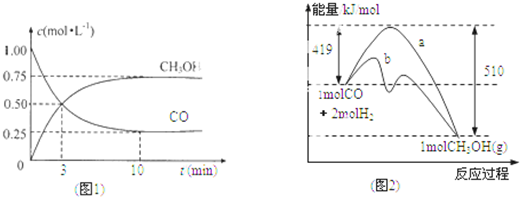
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
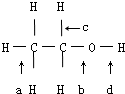 ,判断发生反应其所断裂的键.
,判断发生反应其所断裂的键.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
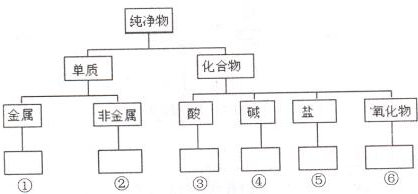 在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:
在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl=H++Cl- | ||
B、Al(NO3)3=Al3++3NO
| ||
C、Na2CO3=2Na++CO
| ||
D、MgCl2=Mg2++Cl
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com