
下列晶体中,前者属于原子晶体,后者属于分子晶体的是( )
A.硅晶体、二氧化硅晶体
B.足球烯(C60)、天然气水合物
C.金刚石、冰
D.干冰、碳化硅
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
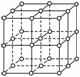
如右图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数为________,即(填计算式)______________________;Na+的个数为________,即(填计算式)______ ___。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气
回答下列问题:
(1)不存在化学键的是________;
(2)存在金属键的是________;
(3)只存在非极性键的是________;
(4)只存在离子键的是________;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.氯化钠晶体结构为非等径圆球的密堆积
B.晶体尽量采取紧密堆积方式使其变得比较稳定
C.由于共价键有方向性和饱和性,所以原子晶体不遵循紧密堆积原则
D.金属铜和镁均以…ABAB…方式堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解。其中6XeF4+12H2O===2XeO3+4Xe↑+24HF+3O2↑,下列推测正确的是( )
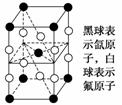
A.XeF2分子中各原子均达到八电子的稳定结构
B.某种氟化氙的晶体结构单元如上图所示,可推知其化学式为XeF6
C.XeF4按已知方式水解,每生成4 mol Xe转移16 mol 电子
D.XeF2加入水中,在水分子的作用下,将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
有关晶体(晶胞)的结构如下图所示,下列说法不正确的是( )

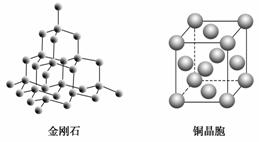
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1∶4
D.铜晶体为面心立方堆积,铜原子的配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
在形成氨气分子时,氮原子中的原子轨道发生sp3杂化生成4个________________,生成的4个杂化轨道中,只有________个含有未成对电子,所以只能与____________个氢原子形成共价键,又因为4个sp3杂化轨道有______________,所以氨气分子中的键角与甲烷不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于离子键的说法中正确的是( )
A.离子键一定在活泼金属和活泼非金属元素的原子之间形成
B.形成离子键时离子间的静电作用指的是静电吸引
C.形成离子键时,离子半径越大离子键就越强
D.非金属元素的原子之间也可以形成离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com