
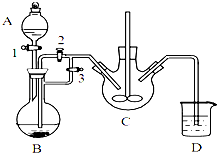
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.分析 (1)(2)亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;
(3)实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉用乳酸除去,Fe被充分利用;
(4)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大;根据离子方程式计算20mL溶液中n(Fe2+),进而计算100mL含有n(Fe2+),再根据m=nM计算乳酸亚铁晶体的质量,进而计算产品中乳酸亚铁晶体的质量分数.
解答 解:亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;
(1)由上述分析可知,NH4HCO3盛放在装置C中,该装置中涉及的主要反应的离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:C;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2;
故答案为:关闭活塞3,打开活塞2;
(3)Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,加入适量乳酸让铁粉反应完全,
故答案为:防止Fe2+离子被氧化;加入适量乳酸让铁粉反应完全;
(4)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.05000mol/L×0.0197L=0.000985mol,故100mL含有n(Fe2+)=0.000985mol×$\frac{100}{20}$=0.004925mol,故产品中乳酸亚铁晶体的质量分数为$\frac{0.004925×288}{1.44}$×100%=98.5%,
故答案为:乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化;98.5%.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.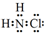 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
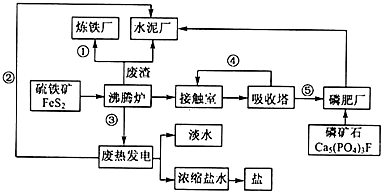 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
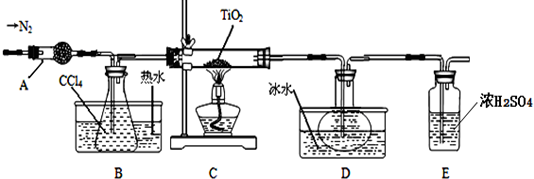
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com