
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
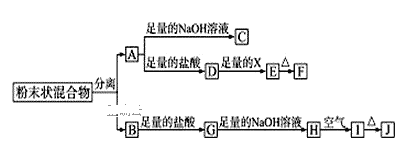
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
【答案】Al2O3 FeCl2 用磁铁石吸 C Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2OH-+2Al+2H2O=2AlO2-+3H2↑ 取少G溶液于试管中,向试管中滴入几滴KSCN溶液无现象,向的混合溶液中再加入氯水,溶液变成红色
【解析】
I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,则E为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3。
I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,则E为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3;
(1)由上述分析可知,F为Al2O3,G为FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
(3)D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水,故答案为C;在Al3+的溶液中滴加氨水时发生的离子反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(4)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)检验FeCl2溶液中的阳离子的方法:取少G溶液于试管中,向试管中滴入几滴KSCN溶液无现象,向的混合溶液中再加入氯水,溶液变成红色。


科目:高中化学 来源: 题型:
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是

A.由 X→Y 反应的 ΔH=E5-E2
B.由 X→Z 反应的 ΔH=E2-E1
C.反应 2X(g)=3Y(g)的活化能=E3-E2
D.2X(g)=Z(s) ΔH<(E1-E2) kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出次氯酸的结构式________;
(2)NaHCO3的俗名是_______;
(3)第四周期第ⅦA原子序数为______,元素符号为_________,其最高价氧化物的水化物化学式为_______;
(4)写出工业上制氯气的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁是重要的还原剂。常用于检测硒,生产氯化铁、聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。已知:

请回答下列问题:
(1)在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,___、___固液分离,洗涤,快速干燥制得。
(2)如图,用H2还原无水FeCl3制取FeCl2。

①图A是用干燥的Cl2和铁粉制取无水FeCl3的装置。硬质玻璃管和收集器用大口管连接的原因是____。
②装置B、C、D、E是用H2还原无水FeCl3制取FeCl2的装置。连接顺序为(可重复使用)___,仪器C中盛放的试剂是___。
(3)按如图所示装置,用162.5g无水氯化铁和225g氯苯,控制反应温度加热3h。冷却,分离提纯得到粗产品。反应为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。

①仪器B的作用是___;C中倒挂漏斗的作用是___。
②反应的温度最好控制在132℃左右。则最佳的加热方式为___(填序号)。
A.直接用酒精灯加热 B.隔石棉网用酒精灯加热
C.水浴加热 D.油浴加热
③通过烧杯C现象变化可以监控氯化铁的转化率。若烧杯C中试剂为加有酚酞且含18gNaOH的溶液,则氯化铁转化率理论上达到或超过___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Na2SiO3溶液中滴加盐酸:Na2SiO3 + 2H+ = H2SiO3↓ + 2Na+
B.Na2SO3水解方程式:SO32- + 2H2O![]() H2SO3 + 2OH-
H2SO3 + 2OH-
C.向FeBr2溶液通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + 4Cl- + Br2
D.明矾中加Ba(OH)2至沉淀的质量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。
(1) Co基态原子核外电子排布式为_________,第二周期元素第一电离能比B高的有______种;
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2中的化学键除了σ键外,还存在______;
(3)NaBO2可用于织物漂白。BO2-的空间构型为_______写出两种与其互为等电子体的分子的化学式:_______;
(4)下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数);

下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为________;

(5)立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为_______________;
(6)一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,该晶体的密度为__gcm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某有机物A,欲推断其结构,进行如下实验:
(1)取15gA 完全燃烧生成22gCO2和9gH2O,该有机物的实验式为_________________。
(2)质谱仪检测得该有机物的相对分子质量为90,则该物质的分子式为__________。
(3)若该有机物在浓硫酸共热的条件下,既能与乙酸反应,又能与乙醇反应,还能2分子A 反应生成含六元环的物质,则A 的结构简式为__________________。
(4)写出A发生缩聚反应生成高分子化合物的方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com