
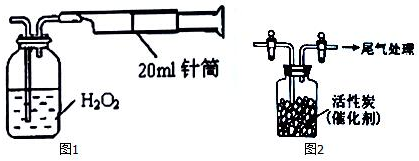
分析 (1)根据S原子质量守恒,生成硫酸钡的物质的量就等于二氧化硫的物质的量,计算出空气中二氧化硫的含量;
(2)根据亚硫酸钡的溶度积,比较溶液中的c(Ba2+)×c(SO32-)乘积与KSP(BaSO3)大小关系,从而判断是否生成沉淀;
(3)二氧化锰和浓盐酸反应生成氯气、氯化锰和水;
(4)SO2Cl2与H2O反应生成硫酸和氯化氢;
(5)SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀.
解答 解:(1)白色沉淀是硫酸钡沉淀,物质的量是:$\frac{0.233×1{0}^{-3}g}{233g/mol}$=1×10-6mol,取样处空气中SO2含量为:$\frac{1×1{0}^{-6}mol×64×1{0}^{3}mg/mol}{0.02L×100}$=0.032mg/L,
故答案为:0.032;
(2)因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀,
故答案为:c(Ba2+)×c(SO32-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,不会生成沉淀,不可以用氯化钡溶液吸收二氧化硫;
(3)二氧化锰和浓盐酸反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)SO2Cl2与水反应的方程式SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
(5)①SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀,故答案为:BaSO4;
②SO2+Cl2?SO2 Cl2,由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体,SO2和Cl2生成SO2Cl2的反应为可逆反应,
故答案为:是,由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体.因此SO2和Cl2生成SO2Cl2的反应为可逆反应.
点评 本题为实验题,考查了二氧化硫的性质,题目难度中等,明确物质的性质是解题关键,注意离子检验的方法.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
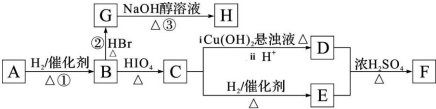
 .若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
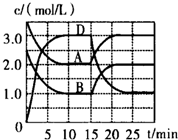 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
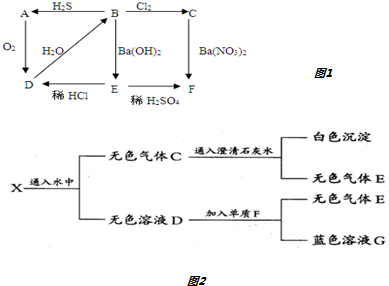
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com