
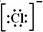 ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.分析 (1)①食盐中阴离子为氯离子,带一个单位的负电荷,据此书写电子式;SO3的沸点为44.8℃,比较低,为分子晶体,分子间为分子间作用力;
②食盐固体和SO3在高温下可以反应,产物为硫酸钠、黄绿色气体A应为氯气和另一种无色有毒气体B应为二氧化硫,根据元素守恒书写化学方程式;
③氯气和二氧化硫在水溶液中反应生成硫酸和氯化氢,据此分析;
(2)①将4molNa2O2和1molFe2O3在氧气流中加热至450℃发生化合反应,得到2mol的钠盐,根据钠元素和铁元素守恒可知,该钠盐的化学式中有4个钠离子和一个铁原子,该钠盐的酸根中含有+4价铁,根据化合价代数和为0可知该化学式为Na4FeO4,Na4FeO4在稀的碱溶液中不稳定,会产生具有消毒及净水作用的Na2FeO4,同时生成红褐色沉淀为氢氧化铁,根据元素守恒和电子得失守恒可写出该反应的化学方程式;
②根据铁被氧化后的化合价可知,溶液中铁元素的存在形式为Fe2+,或Fe3+,或Fe2+和Fe3+的混合物;溶液中Fe2+用铁氰化钾溶液检验,溶液中Fe3+用硫氰化钾溶液检验.
解答 解:(1)①食盐中阴离子为氯离子,带一个单位的负电荷,氯离子的电子式为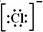 ,SO3的沸点为44.8℃,比较低,为分子晶体,分子间为分子间作用力,所以其汽化时需克服的作用力是分子间作用力,
,SO3的沸点为44.8℃,比较低,为分子晶体,分子间为分子间作用力,所以其汽化时需克服的作用力是分子间作用力,
故答案为: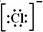 ;分子间作用力;
;分子间作用力;
②食盐固体和SO3在高温下可以反应,产物为硫酸钠、黄绿色气体A应为氯气和另一种无色有毒气体B应为二氧化硫,反应的化学方程式为2NaCl+2SO3$\frac{\underline{\;高温\;}}{\;}$SO2↑+Cl2↑+Na2SO4,
故答案为:2NaCl+2SO3$\frac{\underline{\;高温\;}}{\;}$SO2↑+Cl2↑+Na2SO4;
③氯气和二氧化硫在水溶液中反应生成硫酸和氯化氢,所以将氯气和二氧化硫的混合气体通过饱和食盐水的时候得不到氯气,
故答案为:不合理;氯气和二氧化硫在水溶液中反应生成硫酸和氯化氢;
(2)①将4molNa2O2和1molFe2O3在氧气流中加热至450℃发生化合反应,得到2mol的钠盐,根据钠元素和铁元素守恒可知,该钠盐的化学式中有4个钠离子和一个铁原子,该钠盐的酸根中含有+4价铁,根据化合价代数和为0可知该化学式为Na4FeO4,Na4FeO4在稀的碱溶液中不稳定,会产生具有消毒及净水作用的Na2FeO4,同时生成红褐色沉淀为氢氧化铁,该反应的化学方程式为3Na4FeO4+8H2O=Na2FeO4+2Fe(OH)3↓+10NaOH,
故答案为:Na4FeO4;3Na4FeO4+8H2O=Na2FeO4+2Fe(OH)3↓+10NaOH;
②根据铁被氧化后的化合价可知,溶液中铁元素的存在形式为Fe2+,或Fe3+,或Fe2+和Fe3+的混合物,所以假设三为以Fe2+和Fe3+形式存在,溶液中Fe2+用铁氰化钾溶液检验,溶液中Fe3+用硫氰化钾溶液检验,实验方案为取少量样品试剂滴入铁氰化钾溶液,若有蓝色沉淀,则溶液中有Fe2+,另取少量样品试剂滴入硫氰化钾溶液,若溶液呈血红色,则溶液中有Fe3+,
故答案为:以Fe2+和Fe3+形式存在;取少量样品试剂滴入铁氰化钾溶液,若有蓝色沉淀,则溶液中有Fe2+,另取少量样品试剂滴入硫氰化钾溶液,若溶液呈血红色,则溶液中有Fe3+.
点评 本题考查了电子式、分子间作用力、氧化还原反应、物质的检验等,为高频考点,明确反应中元素守恒和电子得失守恒是解本题关键,知道常见离子的检验方法进行实验方案设计为本题的难点.


科目:高中化学 来源: 题型:选择题
| A. | Li能在空气中燃烧 | B. | Li2O只有共价键 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热不分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Y<X | B. | 简单离子半径:Y<Z | ||
| C. | 盐M的水溶液显酸性 | D. | 最高化合价:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的简单离子均能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.4g CO2物质的量为0.1mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1NA个H2O分子含有氧分子数为1mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 碳酸溶液中的氢离子浓度是碳酸根离子浓度的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
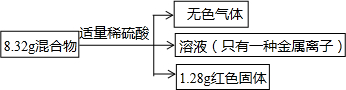
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
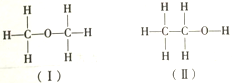 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com