
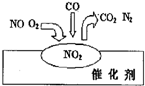
| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
分析 汽车尾气的有害气体主要是氮氧化物、一氧化碳等;通过气体在催化剂表面吸附与解吸作用的过程图,可知NO2在整个过程中是一种中间产物,一氧化氮气体和氧气一氧化碳会在催化剂表面发生反应,转化为无毒气体,起到尾气净化作用.
解答 解:A、气体在催化剂表面吸附与解吸作用的过程中先生成二氧化氮,然后在催化剂表面和一氧化碳反应,最终生成无毒气体,起到尾气净化的作用,是中间产物,而不是最终产物,故A错误;
B、NO和O2在常温下就会发生反应,故B错误;
C、汽车尾气的主要污染成分是CO、NO、NO2等,二氧化碳不是污染气体,故C错误;
D、尾气处理净化的目的是把有毒的污染气体在催化剂作用下转化为空气中的无毒成分:反应方程式2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2正好是过程图中的变化,故D正确;
故选D.
点评 本题主要考查汽车尾气的成分、生成、催化净化原理和反应条件应用.


科目:高中化学 来源: 题型:解答题
| 元素 | X | F | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量逐渐增大 | B. | 核外电子排布呈现周期性变化 | ||
| C. | 原子半径呈现周期性变化 | D. | 元素化合价呈现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有钾元素,仅通过物理变化就可以得到金属钾 | |
| B. | 海水各种化学资源的开发过程中,必须都要发生化学反应 | |
| C. | 从海水中可以得到MgCl2,电解熔融MgCl2,可制备Mg | |
| D. | 利用潮汐发电是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
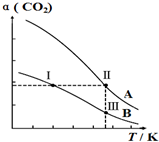 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )| A. | 反应2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)的△S<0、△H<0 | |
| B. | 表示乙容器CO2的平衡转化率随温度变化的是曲线B | |
| C. | 体系中c(CH3OCH3):c(CH3OCH3,状态Ⅱ)<2c(CH3OCH3,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com