
分析 (1)相同浓度的这几种溶液,先按酸、盐、碱分类,酸中氢离子浓度越大,溶液的pH越小;盐溶液中弱碱离子水解程度越大,溶液的pH越小;碱溶液中,氢氧根离子浓度越大,溶液的pH越大;
(2)②、③等体积混合,二者恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,溶液呈碱性;
②、③等体积混合,pH=8,c(Na+)-c(CH3COO-)=c(OH-)-c(H+);
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(4)一水合氨是弱电解质,电离程度较小,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,铵根离子水解程度越大,溶液中铵根离子浓度越小;
(5)将②和③按体积比2:1混合后,溶液中溶质为等物质的量浓度的CH3COOH和CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,结合物料守恒判断;
(6)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大;
在t℃时将pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,
pH=1的H2SO4溶液中c(H+)=0.1mol/L,二者混合后溶液pH=2,混合溶液中c(H+)=0.01mol/L,
则混合溶液中c(H+)=$\frac{0.1×b-0.01×a}{a+b}$mol/L=0.01mol/L,
据此计算a:b.
解答 解:(1)相同浓度的这几种溶液,先按酸、盐、碱分类,酸中氢离子浓度越大,溶液的pH越小;盐溶液中弱碱离子水解程度越大,溶液的pH越小;碱溶液中,氢氧根离子浓度越大,溶液的pH越大,
①硫酸、②醋酸是酸,且硫酸中氢离子浓度大于醋酸,则pH:①<②;
③氢氧化钠、⑦氨水是碱,且氢氧根离子浓度③>⑦,所以pH⑦<③;
④氯化铵、⑤醋酸铵都盐,但氯化铵是强酸弱碱盐、醋酸铵是弱酸弱碱盐,pH④<⑤;
⑥硫酸氢铵是强酸酸式盐,相当于强酸性溶液,氢离子浓度大于②小于①,所以pH①<⑥<②,
通过以上分析知,pH大小顺序是③>⑦>⑤>④>②>⑥>①,
故选C;
(2)②、③等体积混合,二者恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,水解离子方程式为CH3COO-+H2O?CH3COOH+OH-;
②、③等体积混合,pH=8,c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-6-10-8)mol/L=9.9×
10-7mol/L,
故答案为:碱性;CH3COO-+H2O?CH3COOH+OH-;9.9×10-7;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,氯化铵促进水电离、NaOH抑制水电离,所以④由水电离出c(H+)>③中由水电离出c(H+),故答案为:>;
(4)一水合氨是弱电解质,电离程度较小,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,铵根离子水解程度越大,溶液中铵根离子浓度越小,所以铵根离子浓度大小顺序是⑥④⑤⑦,
故答案为:⑥④⑤⑦;
(5)将②和③按体积比2:1混合后,溶液中溶质为等物质的量浓度的CH3COOH和CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,结合物料守恒得离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(6)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,该温度下离子积常数大于25℃,所以该温度高于25℃;
在t℃时将pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,
pH=1的H2SO4溶液中c(H+)=0.1mol/L,二者混合后溶液pH=2,混合溶液中c(H+)=0.01mol/L,
则混合溶液中c(H+)=$\frac{0.1×b-0.01×a}{a+b}$mol/L=0.01mol/L,a:b=9:2,
故答案为:>;9:2.
点评 本题考查酸碱混合溶液定性判断、离子浓度大小比较、弱电解质的电离等知识点,为高频考点,混合溶液pH的计算是学习难点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol/(L•s) | B. | 0.16 mol/(L•s) | C. | 0.32mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乳酸的相对分子质量是72 | |
| B. | 乳酸的分子式是C2H6O3 | |
| C. | 1mol乳酸和适量的金属钠可放出氢气44.8L(标准状况) | |
| D. | 1mol乳酸和少量的碳酸氢钠溶液反应可放出二氧化碳22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
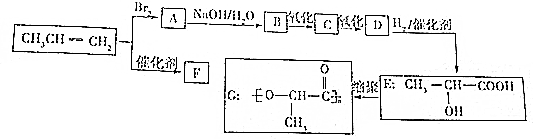
 .
.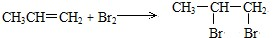 ,反应类型:加成反应;
,反应类型:加成反应;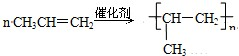 ,反应类型:加聚反应.
,反应类型:加聚反应.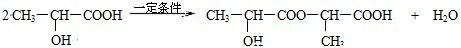 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子方程式 | |
| SiO2(CaCO3) | ||
| FeCl2(FeCl3) | ||
| FeCl3(FeCl2) | ||
| Fe2O3(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O?H2CO3 | B. | OH-+HS-?S2-+H2O | ||
| C. | HS-+H2O?H3O++S2- | D. | S2-+H2?HS-+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com