
【题目】Na2O与Na2O2的相同点是( )
A. 氧元素化合价 B. 颜色状态
C. 阴、阳离子个数比 D. 为碱性氧化物
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在lL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数Ψ,物质的量浓度为cmol/L则下列关系中不正确的是
A. Ψ=17c/(1000p) B. Ψ=17V/(17V+22400)
C. p=17V/(22.4+22.4V)/(17V+22400) D. c=1000Vp/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁(FeCl3)是一种黑棕色结晶,易升华,易溶于水并且有强烈的吸水性。实验室制备无水氯化铁并探究氯化铁的相关实验如下。
I.利用MnO2粉末、浓盐酸、还原铁粉制备无水氯化铁
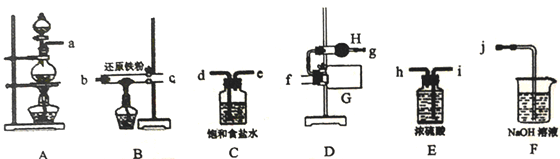
(1)写出装置A中发生的离子方程式_________________________________________。
(2)整套实验装置接口的连接顺序是______________________________________,
仪器H的名称是_________________________。
(3)当出现_________实验现象时,再点燃B处的酒精灯。
II.探究FeCl3的相关性质
(4)将G中所得固体进行相关实验,完成下列实验,回答问题。
序号 | 实验操作 | 实验现象 | 问题或结论 |
① | 取少量G中固体置于烧杯中,加入适量蒸馏水,搅拌,溶解 | 溶液显浑浊,经过处理,得到澄淸溶液. | 该“处理”的操作是①________ |
② | 取少量①中的澄淸溶液于试管中,滴加2滴 ②________溶液 | 无明显现象 | 证明原固体中不含FeCl2, 原固体是FeCl3固体 |
③ | 将SO2气体通入BaCl2溶液中,再滴入①中的澄淸溶液 | 开始无明显现象,后来有白色沉淀生成 | FeCl3表现出③_______ (性质) |
④ | 将①中的澄淸溶液滴入刚刚做完银镜反应实验的试管中,振荡 | 银镜溶解,溶液显浑浊 | 相关离子方程式是④_______ |
Ⅲ.探宄FeCl3与KSCN溶液的反应
(5)向试管中滴加5mL0.01mol/LKSCN溶液,再滴加5mL0.005mol/L FeCl3,溶液显红色,发生反应:Fe3+(aq)+3SCN-(aq)![]() Fe(SCN)3(aq)。将该红色溶液分成2份,分别装于A、B三支试管中,分别完成下列实验。
Fe(SCN)3(aq)。将该红色溶液分成2份,分别装于A、B三支试管中,分别完成下列实验。
序号 | 实验操作 | 实验现象 | 给出合理的解释 |
① | 向A试管中滴加5滴1 mol/L KSCN溶液 | 红色溶液变为血红色 | ①________ |
② | 向B试管中加入lgKCl固体(足量,溶液体积变化忽略不计),振荡,静置 | 固体未完全溶解,红色溶液变浅(接近无色) | ②________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是
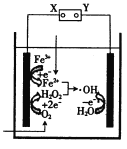
A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液
B. 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极
C. 纯银在空气中久置变黑发生的是化学腐蚀
D. 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)含有6.02×1023个H的H2O,其物质的量是________;1L1 mol /LNa2SO4溶液中含有______个Na+、______个SO![]() 。
。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(5)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(6)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需加热就能发生
C.需要加热才能发生的反应不一定是吸热反应
D.化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①液溴易挥发,在存放液溴的试剂瓶中应加水封
②易燃试剂与强氧化性试剂分开放置并远离火源
③中和滴定实验时,用待测液润洗锥形瓶
④硅酸钠溶液应保存在带玻璃塞的试剂瓶中
A. ①② B. ①②③ C. ③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g)ΔH=+133kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:____________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。_____________
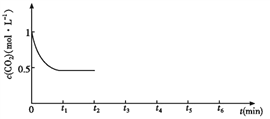
⑵改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______K(II)(填“﹥”“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”“逆向”或“不”)。
⑶利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,
装置如图所示:
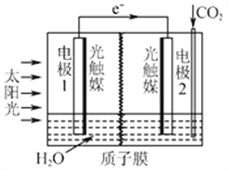
①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com