
| Ź±¼ä£Øs£© ĪļÖŹµÄĮæ£Ømol£© ĪļÖŹ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
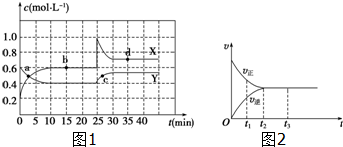
·ÖĪö £Ø1£©¢ŁÓÉĶ¼æÉÖŖ£¬XµÄĪļÖŹµÄĮæŌö¼Ó£¬YµÄĪļÖŹµÄĮæ¼õÉŁ£¬ŌņXĪŖÉś³ÉĪļ£¬YĪŖ·“Ó¦Īļ£¬ŌŁÓÉ10mim“ļµ½Ę½ŗāæÉÖŖX”¢YµÄĪļÖŹµÄĮæ±ä»ÆĮ棬ŌŁøł¾ŻĪļÖŹµÄĮæ±ä»ÆĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±ČŹéŠ“·½³ĢŹ½£»
¢ŚĪļÖŹµÄÅØ¶Č²»·¢Éś±ä»ÆŹ±±ķŹ¾»Æѧ·“Ó¦“¦ÓŚĘ½ŗāדĢ¬£»
£Ø2£©ÓÉĶ¼æÉÖŖ£¬·“Ó¦“ÓÕż·“Ó¦æŖŹ¼£¬ŌŚt2Ö®Ē°Õż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ£¬t2Ź±·“Ó¦µ½“ļĻŽ¶Č£¬ŌŚt2Ö®ŗó»Æѧ·“Ó¦“¦ÓŚ¶ÆĢ¬Ę½ŗāÖŠ£¬ø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ±ä»Æ£»
£Ø3£©¢Łøł¾Żv=$\frac{\frac{”÷n}{V}}{”÷t}$¼ĘĖć20”«30sÖ®¼äÓƶžŃõ»ÆĮņ±ķŹ¾µÄ»Æѧ·“Ó¦Ę½¾łĖŁĀŹ£»
¢Ś¼ÓČė“߻ƼĮ”¢ÉżøßĪĀ¶Č”¢Ōö“óÅØ¶ČµČæÉŅŌŹ¹·“Ó¦ĖŁĀŹŌö“ó£®
½ā“š ½ā£ŗI£®¢ŁÓÉĶ¼æÉÖŖ£¬XµÄĪļÖŹµÄĮæŌö¼Ó£¬YµÄĪļÖŹµÄĮæ¼õÉŁ£¬ŌņXĪŖÉś³ÉĪļ£¬YĪŖ·“Ó¦Īļ£¬ÓÉ10mim“ļµ½Ę½ŗāæÉÖŖ£¬”÷n£ØY£©£ŗ”÷n£ØX£©=£Ø0.6-0.4£©mol£ŗ£Ø0.6-0.2£©mol=1£ŗ2£¬ĪļÖŹµÄĮæ±ä»ÆĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬Ōņ·“Ó¦ĪŖY?2X£¬
¹Ź“š°øĪŖ£ŗY?2X£»
¢ŚÓÉĶ¼æÉÖŖ£¬10”«25min¼°35minÖ®ŗóX”¢YµÄĪļÖŹµÄĮæ²»·¢Éś±ä»Æ£¬ŌņĻąÓ¦Ź±¼ä¶ĪÄŚµÄµć“¦ÓŚ»ÆŃ§Ę½ŗāדĢ¬£¬¼“b”¢d“¦ÓŚ»ÆŃ§Ę½ŗāדĢ¬£¬¹Ź“š°øĪŖ£ŗbd£»
£Ø2£©a£®t1Ź±£¬ÕżÄę·“Ó¦¶¼·¢Éś£¬ĒŅÕż·½Ļņ·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ£¬¹Źa“ķĪó£»
b£®t2Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬Ōņ·“Ó¦µ½“ļĻŽ¶Č£¬¹ŹbÕżČ·£»
c£®t2”«t3£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬»Æѧ·“Ó¦“ļµ½¶ÆĢ¬Ę½ŗā£¬¹Źc“ķĪó£»
d£®t2”«t3£¬ĪŖ»ÆŃ§Ę½ŗāדĢ¬£¬ø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬¹ŹdÕżČ·£»
¹Ź“š°øĪŖ£ŗbd£»
£Ø3£©¢ŁÓÉĖŲ²Ä1æÉÖŖ£¬20”«30sÄŚ¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæµÄ±ä»ÆĮæĪŖ0.5mol-0.35mol=0.15mol£¬Ōņ¶žŃõ»ÆĮņ±ķŹ¾µÄ»Æѧ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ$\frac{\frac{0.15mol}{2L}}{10s}$=0.0075 mol•L-1•s-1£¬
¹Ź“š°øĪŖ£ŗ0.0075 mol•L-1•s-1£»
¢Ś·“Ó¦70sŗó£¬ĘäĖūĢõ¼ž²»±ä£¬Ö»øıäŅ»øöĢõ¼ž£¬Ź¹·“Ó¦ĖŁĀŹŌö“ó£¬æÉŅŌ¼ÓČė“߻ƼĮ”¢ÉżøßĪĀ¶Č”¢Ōö“óÅØ¶ČµČ£¬
¹Ź“š°øĪŖ£ŗ¼ÓČė“߻ƼĮ”¢ÉżøßĪĀ¶Č”¢Ōö“óÅØ¶Č£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦ĖŁĀŹ¼°»ÆŃ§Ę½ŗāĶ¼Ļó£¬Ć÷Č·Ķ¼Ļó֊ׯŗį×ų±ź¼°µć”¢Ļß”¢ĆęµÄŅāŅåŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü£¬ÄѶČÖŠµČ£®


 ÖÜÖÜĒå¼ģ²āĻµĮŠ“š°ø
ÖÜÖÜĒå¼ģ²āĻµĮŠ“š°ø ĒįĒɶį¹ŚÖܲāŌĀæ¼Ö±ĶØøßæ¼ĻµĮŠ“š°ø
ĒįĒɶį¹ŚÖܲāŌĀæ¼Ö±ĶØøßæ¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øł¾ŻŹĒ·ń¾ßÓŠ¶”“ļ¶ūĻÖĻó°Ń·ÖÉ¢Ļµ·ÖĪŖČÜŅŗ”¢½ŗĢ唢×ĒŅŗ | |
| B£® | øł¾ŻŌŚĖ®ČÜŅŗĄļ»ņČŪ»ÆדĢ¬ĻĀŹĒ·ńµ¼µē°ŃĪļÖŹ·ÖĪŖµē½āÖŹ”¢·Ēµē½āÖŹ | |
| C£® | ·²ŹĒŗ¬ÓŠĢ¼ŌŖĖŲµÄĪļÖŹĪŖÓŠ»śĪļ£¬²»ŗ¬Ģ¼ŌŖĖŲµÄĪļÖŹĪŖĪŽ»śĪļ | |
| D£® | øł¾ŻĆÜ¶Č“óŠ”°Ń½šŹō·ÖĪŖĒį½šŹōŗĶÖŲ½šŹō |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| ·ÖĄąŅĄ¾Ż | Ąą±š | ÓŠ»ś»ÆŗĻĪļŠņŗÅ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹ż¶ÉŌŖĖŲ | B£® | Ļ”ÓŠĘųĢå | C£® | Ö÷×åŌŖĖŲ | D£® | Ā±×åŌŖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
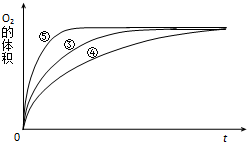 ijŹµŃ銔×éŅŌH2O2·Ö½āĪŖĄż£¬ŃŠ¾æÅØ¶Č”¢“߻ƼĮ”¢ČÜŅŗĖį¼īŠŌ¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ£®ŌŚ³£ĪĀĻĀ°“ÕÕČēĻĀ·½°øĶź³ÉŹµŃ飮
ijŹµŃ銔×éŅŌH2O2·Ö½āĪŖĄż£¬ŃŠ¾æÅØ¶Č”¢“߻ƼĮ”¢ČÜŅŗĖį¼īŠŌ¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ£®ŌŚ³£ĪĀĻĀ°“ÕÕČēĻĀ·½°øĶź³ÉŹµŃ飮| ŹµŃ鱹ŗÅ | ·“Ó¦Īļ | “߻ƼĮ |
| ¢Ł | 10mL2% H2O2ČÜŅŗ | ĪŽ |
| ¢Ś | 10mL5% H2O2ČÜŅŗ | ĪŽ |
| ¢Ū | 10mL5% H2O2ČÜŅŗ | 1mL0.1mol•L-1FeCl3ČÜŅŗ |
| ¢Ü | 10mL5% H2O2ČÜŅŗ+ÉŁĮæHClČÜŅŗ | 1mL0.1mol•L-1FeCl3ČÜŅŗ |
| ¢Ż | 10mL5% H2O2ČÜŅŗ+ÉŁĮæNaOHČÜŅŗ | 1mL0.1mol•L-1FeCl3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® |  | B£® |  | C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com