
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
分析 原电池中,作原电池负极的金属易失电子而被腐蚀,则作原电池正极的金属被保护,电镀时,镀层作电解池阳极,镀件作电解池阴极,含有与阳极相同元素的金属盐作电解质溶液,据此分析解答.
解答 解:A.生铁中含有碳,碳、铁和电解质溶液构成原电池,铁作负极而易被腐蚀,所以生铁的抗腐蚀能力比纯铁弱,故A正确;
B.锡、铁和电解质溶液构成原电池,铁作负极而易被腐蚀,所以用锡焊接的铁质器件,焊接处易生锈,故B正确;
C.在电解池中,当阳极是活性电极时,阳极易被腐蚀,故水库的钢闸门应连接电源的负极才不易被腐蚀,故C错误;
D.轮船上镶嵌锌块,锌、铁和电解质溶液构成原电池,铁作原电池正极而被保护,所以铁管不易被腐蚀,故D正确;
故选:C.
点评 本题考查了金属的腐蚀与防护,知道防止金属被腐蚀的电化学方法有:牺牲阳极的阴极保护法及外加电源的阴极保护法.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
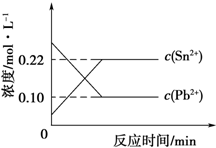 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
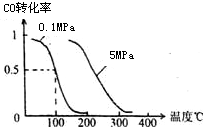 (1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
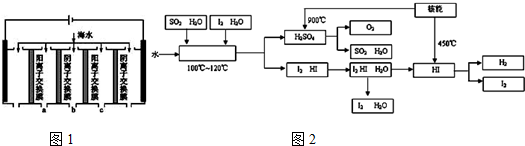
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
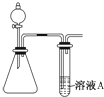 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com