
| A. | ②④⑥⑦ | B. | ②⑤⑦⑧ | C. | ①③⑤⑥ | D. | ②⑤⑥⑧ |
分析 ①NaHCO3溶液加水稀释,促进HCO3-的水解,溶液中碳酸氢根离子浓度减小;
②根据碳酸钠、碳酸氢钠混合液中的物料守恒判断;
③二者恰好完全中和生成氯化铵,为强酸弱碱盐,水解呈酸性;
④亚硫酸钠溶液中加入氢氧化钠,钠离子浓度增大,同时氢氧根离子浓度增大抑制了亚硫酸根离子的水解,导致亚硫酸根离子浓度也增大;
⑤①NH4HSO4 ②NH4HCO3③NH4Cl,溶液中c(NH4+)根据盐类水解的影响分析判断;
⑥NaHSO3溶液显酸性,亚硫酸氢根离子电离程度大于其水解程度;
⑦CH3COONa和CH3COOH混合溶液PH=7,显示中性,据电荷守恒、溶液组成来判断;
⑧依据溶液中电荷守恒和物料守恒分析判断.
解答 解:①NaHCO3溶液加水稀释,促进HCO3-的水解,n(HCO3-)减小,n(Na+)不变,则$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值会增大,故①正确;
②浓度均为0.1mol•L-1的Na2CO3、NaHCO3混合溶液,假设体积为1L,则n(Na+)=0.3mol,而c(CO32-)+c(HCO3-)+c(H2CO3)=0.2mol,则:2c(Na+)═3[c(CO32-)+c(H2CO3)+c(HCO3-)],故②错误;
③在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和生成氯化铵,铵根离子水解促进了水的电离,此时pH=a,则溶液中水电离的c(OH-)=c(H+)=10-amol•L-1,故③正确;
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,溶液中钠离子、氢氧根离子浓度增大,氢氧根离子抑制了亚硫酸根离子的水解,则亚硫酸根离子浓度增大,所以c(Na+)、c(SO32-)均增大,故④正确;
⑤溶液中③NH4Cl中铵根离子的水解既没被促进也没被抑制,②NH4HCO3中NH4+水解显酸性,HCO3-水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,①NH4HSO4中氢离子对铵根离子的水解有抑制作用,铵根离子水解程度变小,即溶液中c(NH4+)①>③>②,故⑤错误;
⑥NaHSO3溶液显酸性,亚硫酸氢根离子电离程度大于其水解程度,溶液中离子浓度为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故⑥错误;
⑦CH3COONa和CH3COOH混合溶液PH=7,c(H+)=c(OH-),根据电荷守恒,所以c(Na+)=c(CH3COO-)=O.1mol/l,c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故⑦正确;
⑧0.1 mol/L HX与0.1 mol/L NaX的混合溶液中才电荷守恒:[H+]+[Na+]=[OH-]+[X-],物料守恒2[Na+]=[X-]+[HX],得到2[H+]-2[OH-]=[X-]-[HX],故⑧错误;
错误的有②⑤⑥⑧,
故选D.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡问题.


科目:高中化学 来源: 题型:选择题
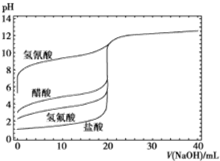 如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )
如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )| A. | 酸性:HF>CH3COOH>HCN | |
| B. | 用NaOH溶液滴定醋酸时,应用酚酞做指示剂不能使用甲基橙 | |
| C. | 当加入10mLNaOH溶液时,c(CN-)>c(CH3COO-) | |
| D. | 随NaOH溶液的滴入,CH3COOH溶液中水的电离程度先变大后变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 g | B. | 24 g | C. | 32 g | D. | 64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g C2H6中含有的化学键数目为8NA | |
| B. | 1 L0.1mol•L-1醋酸溶液中含有的H+数为0.1 NA | |
| C. | 78 g Na2O2;和Na2S的混合物中含有的阴离子数目为NA | |
| D. | 2.24 L CI2与足量铁粉在一定条件下充分反应,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H<0,反应物总能量>生成物总能量 | |
| B. | 相同条件下1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
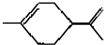 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H18 | |
| D. | 与过量的溴的CCl4溶液反应后产物为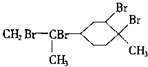 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H-H键断裂的同时有1 mol H-I键形成 | |
| B. | 1 mol H-H键断裂的同时有2 mol H-I键形成 | |
| C. | 1 mol I-I键断裂的同时有2 mol H--I键形成 | |
| D. | 1 mol H-H键断裂的同时有1 mol I-I键形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com