

 ,故答案为:
,故答案为: .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔 |
| B、1,3-丁二烯 |
| C、1-丙炔 |
| D、1,3-环己二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
| B、检验NH4+时,向试样中加入NaOH溶液并加热,用湿润红色石蕊试纸检验逸出的气体 |
| C、用分液漏斗滴加溶液时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔 |
| D、玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑦ | B、②④⑦⑧ |
| C、③④⑤⑧ | D、②③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
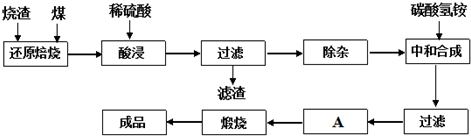
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
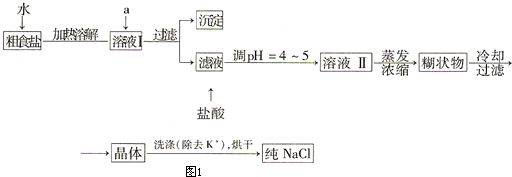
| ||
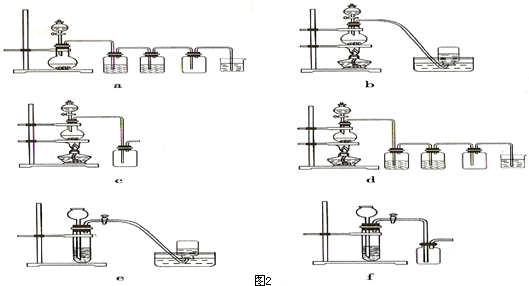
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe粉中混有Al粉杂质(稀H2SO4) |
| B、FeCl3中混有FeCl2杂质(Cl2) |
| C、CO气体中混有CO2杂质(NaOH溶液) |
| D、SiO2中混有CaCO3杂质(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加C的量 |
| B、将容器的体积缩小一半 |
| C、投入一块钠 |
| D、保持压强不变,充入Ar使容器容积变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com