
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1 mol HCl气体时放出Q1 kJ热量 | |
| D. | 1 mol HBr(g)具有的能量小于1 mol HBr(l)具有的能量 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次减弱 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| D. | 熔融状态能导电的化合物一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
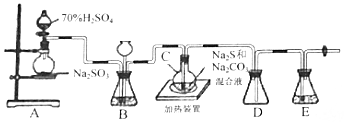
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此将胶体与溶液、悬浊液区分开来 | |
| C. | 光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com