
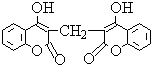
 某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )
某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )| A. | 有望将它发展制得一种抗凝血药 | |
| B. | 它无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药 | |
| C. | 它可由化合物和甲醛(HCHO)通过缩合反应制得 | |
| D. | 它与足量NaOH溶液反应,消耗NaOH 6mol |
分析 由双香豆素的结构可知,分子中含-COOC-、-OH、碳碳双键,结合酯、醇、烯烃的性质来解答.
解答 解:A.由信息可知,小母牛食用腐败草料后,血液不会凝固,则有望将它发展制得一种抗凝血药,故A正确;
B.含苯环,为芳香族化合物,无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药,故B正确;
C.由结构可知,该物质可由 和甲醛(HCHO)通过缩合反应制得,故C正确;
和甲醛(HCHO)通过缩合反应制得,故C正确;
D.只有-COOC-及水解生成的酚-OH与NaOH反应,则1mol它与足量NaOH溶液反应,消耗NaOH 4mol,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团与性质的关系为解答的关键,侧重分析及应用能力的考查,选项C为解答的难点,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 ;
;| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知氮化铝的晶胞结构如图所示.请回答下列问题:
已知氮化铝的晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知:①A 是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;
已知:①A 是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O2和1mol N2所占的体积都约为22.4L | |
| B. | 在标准状况下,H2的气体摩尔体积为22.4L | |
| C. | 在标准状况下,1mol H2和1mol H2O所占的体积都约22.4L | |
| D. | 在标准状况下,22.4L由N2,N2O组成的混合气体中所含有的氮原子的物质的量约为2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com