
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
分析 Fe2(SO4)3溶液中铁离子部分水解,导致溶液显示酸性,其中的铁离子具有氧化性,能和还原性的物质反应,结合离子之间的反应来解答.
解答 解:A.Fe3+、SCN-结合生成络离子,不能大量共存,故A错误;
B.和KI溶液反应的离子方程式为2Fe3++2I-═2Fe2++I2,故B错误;
C.和Ba(OH)2溶液反应离子方程式为2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓,故C错误;
D.100mL 0.1 mol/L该溶液中含有溶质硫酸铁0.01mol,0.01mol硫酸铁中含有0.02mol铁离子,与足量锌反应可以生成0.02mol铁,生成铁的质量为1.12g,故D正确.
故选D.
点评 本题考查离子的共存及离子反应,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
 如图是M、N两种物质的溶解度曲线.t2℃时往盛有100g水的烧杯中先后加入ag M和ag N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌.降温至t1℃,下列说法正确的是( )
如图是M、N两种物质的溶解度曲线.t2℃时往盛有100g水的烧杯中先后加入ag M和ag N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌.降温至t1℃,下列说法正确的是( )| A. | t2℃时,得到M的饱和溶液 | |
| B. | t2℃时,得到N的不饱和溶液 | |
| C. | 温度降低到t1℃时,得到M、N的不饱和溶液,且溶液中溶质的质量分数相等 | |
| D. | 温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是物质的化学变化都伴随着能量的变化 | |
| B. | 凡是物质的化学变化就一定只伴随着化学能与热能的转化 | |
| C. | 凡是吸热反应都需要人为加热 | |
| D. | 任何放热反应在常温下一定能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全对 | B. | 除①外全对 | C. | 除②外全对 | D. | 除③外全对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能够在空气中燃烧 | B. | 都能够与水反应 | ||
| C. | 都是柔软的银白色金属(铯略带金色) | D. | 都可以保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向平衡体系中加入少量KCl固体或Fe(SCN)3固体,溶液红色都变浅 | |
| B. | 向平衡体系中加入少量FeCl3固体或KSCN固体,溶液红色加深 | |
| C. | 向平衡体系中加入水稀释,平衡不移动,但溶液红色变浅 | |
| D. | 该反应的离子方程式为:3KSCN+Fe3+═Fe(SCN)3(血红色)+3K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
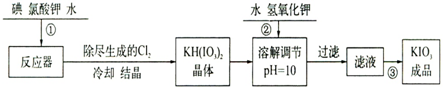
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,甲3mL水配制溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol.L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1滴1mol.L-1的H2SO4,从发振荡 | 溶液变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com