
学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。
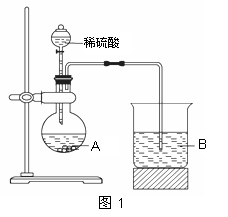
甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
(1)写出选用物质的化学式:
A 、B 。
根据实验目的,烧杯B中发生反应的离子方程式
,
通过实验得出的结论:元素非金属性强弱顺序为
。
乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。
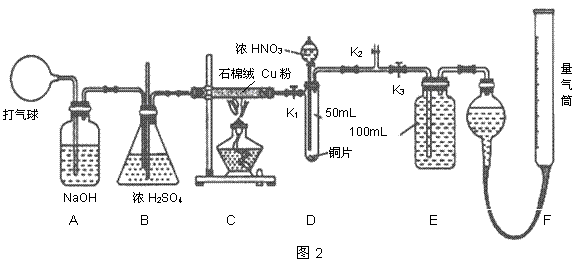
(2)乙组同学实验过程如下:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为橙黄色时,立即关闭活塞a。
IV……
①B中溶液发生反应的离子方程式是 。
②为验证溴的氧化性强于碘,过程IV的操作和现象是
操作 ;
现象 。
③过程II实验的目的是 。
科目:高中化学 来源: 题型:
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖。某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
A.烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为
6H++6e-=3H2↑
B.烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极,
C.烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极
D.烧杯②中,固体最终完全溶解,溶液呈蓝色。向溶液中滴加KSCN溶液,溶液不变色。
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A.2NaBr+Cl2 ══ 2NaCl+Br2 B.C+CO2 2CO
2CO
C.2H2S+SO2══ 2H2O+3S↓
D.AlCl3+3NaAlO2+6H2O ══ 4Al(OH)3↓+3NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是周期表中相邻的三种短周期元素,它们原子半径依次减小,X与Z的核电荷数之比为3∶4,X、Y、Z分别与氢元素形成氢化物。下列叙述正确的是( )
A.Z是第二周期IVA族元素 B.最高价氧化物对应的水化物的酸性: Y﹥X
C.非金属性:X﹥Y﹥Z D.X、Y、Z的氢化物稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
 A.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度
A.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度
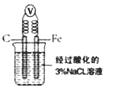
B.如右图,一段时间后给烧杯内地溶液中加入黄色的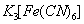 溶液,可看到Fe电极附近有蓝色沉淀生成
溶液,可看到Fe电极附近有蓝色沉淀生成
C.用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
D.用加热的方式可提取 固体中混有的少量的碘
固体中混有的少量的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
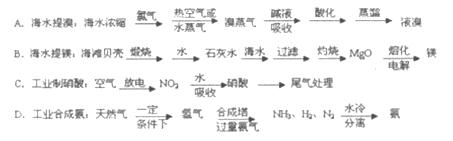
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下:
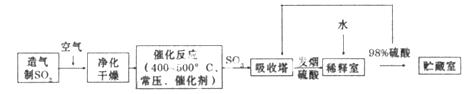
 请回答下列问题
请回答下列问题
 (1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g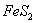 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量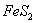 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有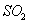 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中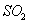 平衡转化率与温度及压强关系如图2所示、在实际生产中,
平衡转化率与温度及压强关系如图2所示、在实际生产中,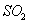 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、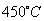 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择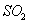 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 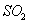 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的共页生产流程中正确的是
A.向装置中通入氮气且保持体积不变
B.向装置中通入氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)由吸收塔排出的尾气中有SO2的含量如果超过500μL/ L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.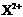 的核外电子数目为18,则X在第四周期第ⅡA族
的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
A.聚丙烯的结构简式: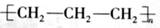
B.丙烷分子的比例模型:
C.四氯化碳分子的电子式: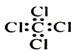
D.2-乙基-1,3-丁二烯分子的键线式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com